Substâncias húmicas: um breve relato sobre sua importância e suas interações
Thainá Louzada dos Santos
Mestranda em Tecnologia Ambiental (UFF/PGTA)
Lílian Weitzel Coelho Paes
Doutora em Química Inorgânica, professora (UFF/PGTA)
Introdução
A população mundial aumentou nas últimas décadas, tornando maior a demanda quanto à produção de alimentos e bens de consumo. Na busca de promover uma quantidade de alimento satisfatória, foram utilizados em grande escala insumos químicos que contaminam o ambiente por meio de resíduos industriais que são descartados inadequadamente (Yel; Ahmetli, 2010; Coles; Yong, 2006).
O solo é considerado um sistema vivo em evolução contínua e apresenta organismos que são dependentes da matéria orgânica, que lhes fornece nutrientes primordiais para sua sobrevivência e energia. (Vaz, 2006).
Ao longo dos últimos anos, numerosos casos de contaminação do solo têm sido detectados em áreas urbanas e em zonas rurais, trazendo preocupações ambientais significativas, pois interferem geralmente no ambiente global da área afetada (vegetação, ar, fauna, águas superficiais e subterrâneas), podendo resultar em problemas de saúde pública (Martins et al., 2011).
A matéria orgânica do solo (MOS) é considerada uma importante indicadora da qualidade desse meio, devido à capacidade de modular as condições químicas, físicas e biológicas do solo e, assim, sua eficiência nutricional (Costa et al., 2013). É encontrada em solos, sedimentos e águas naturais, podendo ser dividida em duas classes de compostos: as substâncias não húmicas (como proteínas, polissacarídeos, ácidos nucleicos, açúcares e aminoácidos) e as substâncias húmicas (Fontana, 2009; Atiyeh et al., 2002).
As substâncias húmicas: composição e natureza química
Reconhecidas durante muito tempo como o componente orgânico mais amplamente distribuído no planeta, as substâncias húmicas (SH) estão presentes tanto em ambientes aquáticos como em terrestres (García, 2003).
As substâncias húmicas são formadas a partir da degradação química e biológica de resíduos de plantas, animais e atividades microbianas; possuem abundância de grupos carbonila e fenólicos que contribuem para sua complexação e troca iônica (Figura 1); além disso, apresentam características anfipáticas e podem se ligar às superfícies minerais do solo (Mikkelsen, 2005; Vaz, 2006; Burlakovs et al., 2013).
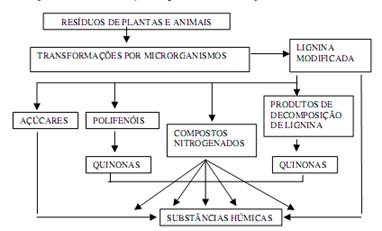
Figura 1. Formação das substâncias húmicas na natureza
Fonte: Extraído de Vaz (2006).
Considerando a solubilidade em meio aquoso, essas substâncias são classificadas usualmente em ácidos fúlvicos, humina e ácidos húmicos (Filho; Silva, 2002).
Os ácidos húmicos são solúveis em meio alcalino e de cor escura e insolúveis em meio ácido (pH < 2), apresentando-se amorfos e mantendo a coloração. São quimicamente muito complexos, formados por polímeros, compostos aromáticos e alifáticos com elevado peso molecular e grande capacidade de troca catiônica (Botero, 2010).
Estrutura molecular das substâncias húmicas
Segundo Canellas e Santos (2005), ao longo dos anos a estrutura molecular das SH tem sido objeto de inúmeras investigações.
Várias técnicas foram e tem sido utilizadas na busca de uma estrutura para essas substâncias, destacando-se a ressonância magnética nuclear de hidrogênio (1H-NMR) e de carbono 13 (13C-NMR), a análise elementar, a pirólise acoplada a cromatografia gasosa e espectrometria de massa (Py-GC/MS), as espectroscopias nas regiões do infravermelho (FTIR) e ultravioleta visível (UV-vis), a eletroforese capilar (CZE), o espalhamento de luz e a cromatografia de exclusão por tamanho (SEC) entre muitas outras (Primo et al., 2011; Oliveira, 2011; Novotny, 2002).
Nos estudos de Colombo (2005), as substâncias húmicas já eram compreendidas como uma mistura complexa de substâncias orgânicas com natureza principalmente coloidal e com propriedades ácidas no final do século XIX; também já eram conhecidas informações sobre a sua interação com outros componentes do solo.
Inúmeros trabalhos no início do século XX tiveram como objetivo propor a estrutura e a natureza química das substâncias húmicas; nesse mesmo período a origem química das substâncias húmicas foi tema de inúmeros trabalhos (Colombo, 2005; Novotny, 2002).
Novotny e Ales em 2014 demonstraram em seus trabalhos a estrutura das substâncias proposta por Fuchs em 1931, sendo esta considerada a mais popular (Figura 2).
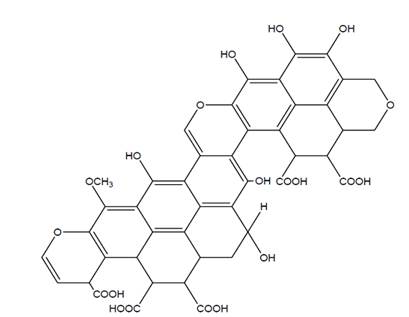
Figura 2. Modelo de ácido húmico proposto por Fuchs (1931)
Fonte: Extraído de Ales (2014).
Ales (2014), em seus estudos, demonstrou o modelo de ácido húmico proposto por Dragunov em 1948, em que anéis aromáticos substituídos por grupos hidroxilas e quinonas constituíam as substâncias húmicas; os anéis aromáticos eram ligados por grupos formaldeído (-CH2O-) e cianeto CN-. Novotny (2002), Colombo (2005) e Ales (2014) demonstram que ligados a carbonos estariam carboidratos e peptídeos que uniriam os anéis aromáticos aos grupos CH2 que estão diretamente ligados aos anéis (Figura 3).
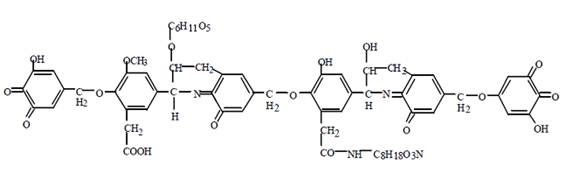
Figura 3. Modelo de ácido húmico proposto por Dragunov (1948)
Fonte: Extraído de Ales (2014).
Em seus estudos, Colombo (2005) demonstrou o modelo de Flaig de 1964, em que a estrutura apresentava anéis aromáticos e quinonas que eram substituídas por grupos hidroxilas, carbonilas e metoxilas (Figura 4).
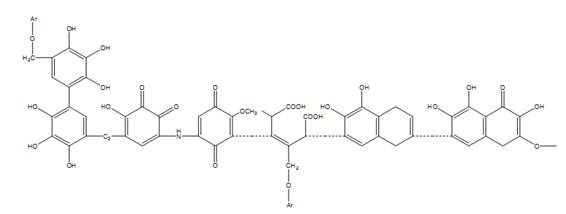
Figura 4. Modelo de ácido húmico proposto por Flaig (1964)
Fonte: Extraído de Novotny (2002).
O modelo proposto por Keinehmpel em 1970 foi discutido nos trabalhos de Novotny (2002) e Colombo (2005), em que os núcleos aromáticos estariam conectados por átomos de oxigênio e nitrogênio, entre outros átomos considerados pontes, enquanto nas estruturas lineares seriam encontrados os polissacarídeos e peptídeos (Figura 5); o papel dos cátions polivalentes, como o Fe2+, na associação entre a porção mineral do solo e as substâncias húmicas foi demonstrado nesse modelo.
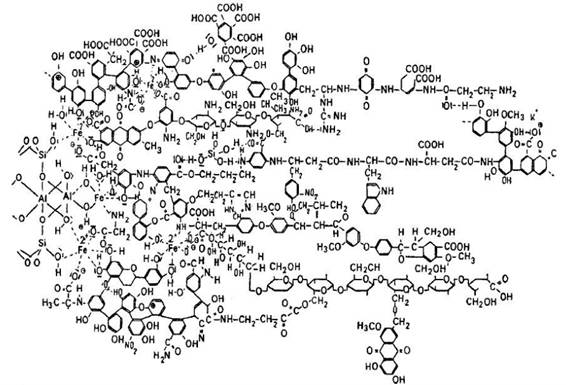
Figura 5: Modelo de ácido húmico proposto por Keinehmpel (1970)
Fonte: Extraído de Ales (2014).
A estrutura proposta por Stevenson em 1982 demonstra a presença de ligações de hidrogênio com estruturas do tipo quinona, além de indicar a ocorrência de resíduos de carboidratos e proteínas (Figura 6) e foi discutida no trabalho de Novotny em 2002.
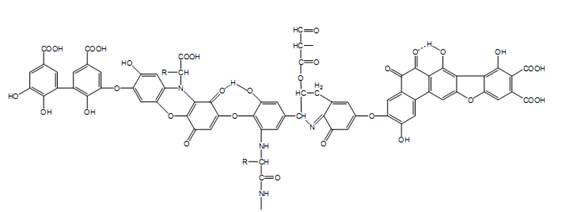
Figura 6: Modelo de ácido húmico proposto por Stevenson (1982)
Fonte: Extraído de Novotny (2002).
Filho e Silva (2002), Barriquelo (2005), Vaz (2006) e Arend (2010) demonstraram o modelo de Schulten e Schnitzer descrito em 1993, que, ao enfocar um número significativo de porções alifáticas, apresentou uma nova concepção de modelo estrutural para as substâncias em questão. Tem-se observado, segundo os modelos propostos recentemente, que a estrutura das substâncias húmicas apresenta espaços vazios de diferentes tamanhos, possibilitando que outros compostos orgânicos hidrofílicos ou hidrofóbicos, como carboidratos e matérias proteináceas, lipídeos, agrotóxicos e outros poluentes, bem como elementos inorgânicos se alojem (Figura 7).
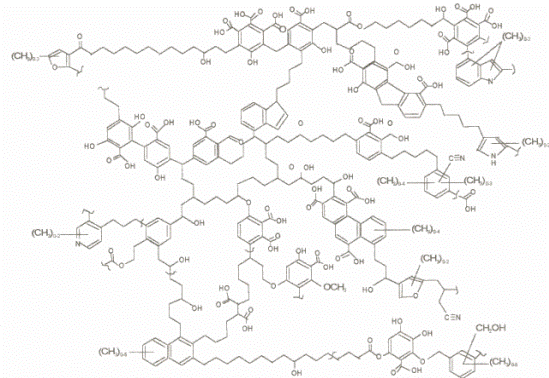
Figura 7. Estrutura bidimensional proposta para os ácidos húmicos proposta por Schulten e Schnitzer (1993).
Fonte: Extraído de Filho; Silva (2002).
Nos estudos de Filho e Silva (2002), Novotny (2002) e Colombo (2005) foi relatado o modelo que Schulten e Schnitzer apresentaram em 1995, que é uma estrutura tridimensional do modelo que foi proposto em 1993; foi constatado que, otimizando essas moléculas por meio de cálculos matemáticos, esse modelo apresentava uma série de espaços vazios de diferentes tamanhos, em que compostos orgânicos, hidrofílicos ou hidrofóbicos, poderiam se alojar. As letras A, B e C representam os espaços por onde a molécula interage com outros compostos e os átomos em azul (carbono), em branco (hidrogênio), em vermelho (oxigênio) e em azul escuro (nitrogênio) (Figura 8).
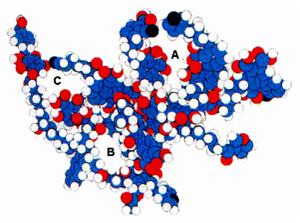
Figura 8: Estrutura para o ácido húmico proposta por Schulten e Schnitzer (1995).
Fonte: Extraído de Novotny (2002).
Importância das substâncias húmicas no meio ambiente
Devido a diversas características, no meio ambiente as substâncias húmicas podem desempenhar importante papel, como contribuir para a retenção de calor, devido à sua coloração escura nos solos e sedimentos, fato que estimula a germinação de sementes e o desenvolvimento de raízes; atuar contra a erosão, evitando o escoamento, pois, por apresentar agregados oriundos da combinação com argilas, possuem alta capacidade de retenção de água; também estimulam o crescimento do fitoplâncton em ambientes aquáticos, visto que governam a produtividade primária; além disso, em águas superficiais participam de reações fotoquímicas (Oliveira, 2011; Primo et al., 2011; Novotny, 2002).
Os grupos funcionais distintos presentes nas substâncias húmicas, tais como carbonilas e hidroxilas fenólicas, fazem com que elas assumam um comportamento polieletrolítico, atuando como agentes complexantes de diversos íons metálicos; são também capazes de adsorver diversos poluentes orgânicos, como pesticidas, diminuindo assim as concentrações desses materiais no ambiente (Oliveira, 2011).
As substâncias húmicas são consideradas fonte de energia para os organismos benéficos do solo, como algas, fungos, bactérias e pequenos animais; esses organismos não apresentam aparato fotossintético para capturar energia do sol, devendo portanto sobreviver em substâncias sobre ou no solo contendo carbono residual (Whitby; Van der Berg, 2015).
Segundo Primo et al. (2011), a capacidade de reter a água é a função mais importante das substâncias húmicas no solo; essas substâncias, ao criar uma estrutura nesse ambiente, facilitam a infiltração da água, pois funcionam como esponjas devido à sua grande área de superfície e às cargas elétricas internas. A capacidade de retenção de água da matéria orgânica fresca gira em torno de 80% do seu peso; essa capacidade se eleva para 160% à medida que a matéria orgânica vai sendo humificada.
A quantidade de água disponível é um dos componentes mais importantes de um solo fértil. Solos que apresentam altas concentrações de substâncias húmicas são capazes de reter água, possibilitando o uso desse elemento durante os períodos de seca; dessa forma, produtores que integram práticas de produção que preservam substâncias húmicas e utilizam fertilizantes que apresentam humatos em sua composição podem colher uma boa safra durante períodos de tempo seco (López et al., 2013; Yel; Ahmetli, 2010).
Além das características já citadas, as substâncias húmicas são também consideradas as principais reguladoras de troca catiônica (CTC), além de formar complexos com íons micronutrientes de plantas, permitindo que eles migrem, o que os torna biodisponíveis (Primo et al., 2011).
Interação das substâncias húmicas com íons metálicos
Devido à sua função quelante, as substâncias húmicas podem formar compostos de coordenação; relacionada a essa interação, foi desenvolvida por Beth e Van Vleck a denominada Teoria do Campo Cristalino (TCC). Essa teoria define um composto de coordenação como um íon metálico central cercado por íons ou ligantes polares que são atraídos eletrostaticamente pelo íon metálico (Shriver; Atkins, 2003). Essas ligações aprisionam esses íons, estabilizando-os e auxiliando na degradação de substâncias tóxicas, como a maioria dos pesticidas orgânicos, reduzindo os seus efeitos para organismos aquáticos e solos (Whitby; Van der Berg, 2015; Vetrova et al., 2014).
O pH é um fator que influencia as interações entre os ácidos húmicos e os íons metálicos, pois em pH baixo os íons metálicos são solúveis, estando na forma Mn+ (aq), sendo os ácidos húmicos não solúveis. Em pH elevado, os íons metálicos encontram-se na sua forma não solúvel, enquanto os ácidos húmicos são solúveis. Já o ácido fúlvico é solúvel em larga faixa de pH; assim, a maioria dos trabalhos que relatam as interações entre as substâncias húmicas e os íons metálicos se restringe a esse ácido (Pombo,1992).
Holtzclaw et al. (1978) comprovaram a restrição do pH em seu estudo quando analisavam a distribuição de diversos metais pesados entre as frações de ácidos húmicos, ácidos fúlvicos e precipitáveis (fosfatos e hidróxidos metálicos), evidenciando que Cd e Ni tendem a se associar às frações precipitáveis e ao ácido fúlvico.
Para Stevenson (1994), o entendimento das reações dos ácidos húmicos com os íons metálicos é variável devido à presença da mistura dos ligantes encontrados nos diferentes grupos funcionais e também à capacidade de dissociação dos grupamentos funcionais em diferentes faixas de pH, permitindo que os ácidos húmicos atuem como polieletrólitos fracos; além disso, os ácidos húmicos apresentam flexibilidade estrutural pelo fato de poderem ou não estar dissolvidos na solução do solo (Canellas et al., 2009).
Em seu estudo de adsorção de Cu2+ e Cd2+ em ácidos húmicos extraídos de resíduos orgânicos de origem urbana, Canellas et al. (2009) concluíram que esses ácidos apresentam grande capacidade em adsorver os íons citados; além disso, concluíram também que os ácidos húmicos extraídos dos compostos de resíduo urbano apresentaram maior capacidade de adsorção quando comparados com os extraídos do lodo da estação de tratamento de esgoto, porém com menor energia.
No estudo sobre a tolerância do alumínio (III) em plantas, Conceição et al. (2008) afirmam que em solos com altas precipitações pluviométricas, como nos tropicais e os subtropicais úmidos, os nutrientes solúveis como Ca+2, Mg+2, K+2 e outros elementos básicos são lixiviados; com a remoção desses cátions e a degradação da matéria orgânica, o pH do solo é reduzido. O pH baixo influencia na liberação dos íons do Al+3, que ficam retidos pelas cargas negativas das partículas de argila que estão presentes no solo; assim, quanto maior a acidez do solo maior será a quantidade desse íon disponível para as plantas. A elevada concentração de alumínio é considerada um fator limitante ao desenvolvimento das plantas, pois sua presença reduz o crescimento das raízes, afetando o seu desenvolvimento, levando à diminuição da absorção de nutrientes, afetando a produção agrícola (Miguel et al., 2010).
Considerado um micronutriente essencial para a manutenção da vida, o ferro está pouco disponível na maioria dos solos (Alexandre et al., 2012); esse fato é consequência da formação de complexos insolúveis na presença de oxigênio e em condições de pH neutro ou alcalino. Em excesso no solo, o ferro pode interferir na absorção de outros elementos, como zinco, manganês, cobre, cálcio, fósforo, cobalto e cálcio (Wolter, 2010); outro sintoma desse processo é o alaranjado que se inicia quando as folhas inferiores apresentam suas extremidades amareladas, quadro que evolui para a base das folhas superiores, até que todas sequem completamente (Mothé, 2012).
Buscando compreender como ocorre a ligação entre os ácidos húmicos e o cobre em águas marinhas, Whitby; Van der Berg (2015) concluíram que a presença da ligação dos ácidos húmicos com o metal demonstra a importância destes ácidos nesse meio, visto que o cobre é um importante micronutriente, porém em elevadas concentrações pode afetar o crescimento de micronutrientes.
A compreensão dos mecanismos da interação de ácidos húmicos com os íons metálicos, para Chen et al. (2006), faz-se necessária para que sejam desenvolvidos métodos para o controle ativo de mitigação de poluentes no meio ambiente natural, bem como para a obtenção de novos materiais a serem utilizados para a proteção desse meio.
O descarte inadequado de resíduos e a utilização não sustentável dos recursos naturais resultam na degradação ambiental; a magnitude dos possíveis danos inviabiliza o solo e a matéria orgânica nele encontrada, que é essencial para a sobrevivência de diversos seres vivos.
As substâncias húmicas, que são derivadas da matéria orgânica, desempenham importante papel ambiental devido às suas características químicas, possibilitando a interação com íons metálicos que podem ser encontrados em substâncias tóxicas, degradando o meio ambiente.
Dentro desse contexto, o estudo da interação das substâncias húmicas com íons metálicos tem despertado grande interesse.
De acordo com os trabalhos citados, as substâncias húmicas são capazes de interagir com diferentes íons metálicos que desempenham várias funções no meio ambiente; considerando que estes íons metálicos fazem parte da composição de insumos agrícolas como agrotóxicos, pesticidas e herbicidas que, em contato com o solo, corpos d'água, fauna e flora, influenciam seus ciclos, podendo causar contaminações severas e alterações genéticas, é de suma importância os estudos desenvolvidos e os estudos vindouros. Dessa forma, a compreensão das interações entre as substâncias húmicas e os íons metálicos contribui para o desenvolvimento sustentável e para a preservação do meio ambiente.
Referências
ALES, R. Metodologia para obtenção de imagens de ácido húmico por meio da técnica de microscopia de força atômica. Dissertação (Mestrado em Ciências). Setor de Ciências Exatas e Naturais, Universidade Estadual de Ponta Grossa. Ponta Grossa, 2014.
ALEXANDRE, M. J. R.; OLIVEIRA, M. L. F.; SANTOS, T. C.; CANTON, G. C.; CONCEIÇÃO, J. M.; EUTROPIO, F. J.; CRUZ, Z. M. A.; DOBBS, L. B.; RAMOS, A. C. Zinco e ferro: de micronutrientes a contaminantes de solo. Natureza on line, v. 10(1), p. 23-28, 2012.
ANDRADE, M. G.; MELO, V. F.; GABARDO, J.; SOUZA, L. C. P.; REISSMANN, C. B. Metais pesados em solos de área de mineração e metalurgia de chumbo. I - Fitoextração. Revista Brasileira de Ciência do Solo, v. 33, p. 1.879-1.888, 2009.
AREND, K. Substâncias húmicas e formas de cobre em solos de áreas de videira. Tese (Doutorado em Ciência do Solo). Centro de Ciências Rurais, Universidade Federal de Santa Maria. Santa Maria, 2010.
ATIYEH, R. M.; LEE, S.; EDWARDS, C. A.; ARANCON, N. Q.; METZEGER, J. D. The influence of humic acids derived from earthworm- processed organic wastes on plant growth. Biorsource Technology, v. 84, p. 7-14, 2002.
BARRIQUELO, M. F. Influência de íons metálicos na estrutura de substâncias húmicas detectadas por eletroscopia. Tese (Doutorado em Ciências). Centro de Ciências Exatas e Tecnologia, Universidade Federal de São Carlos. São Carlos, 2005.
BOTERO, W. G. Substâncias húmicas: interações com nutrientes e contaminantes. Tese (Doutorado em Química). Instituto de Química, Universidade Estadual Paulista. Araraquara, 2010.
BURLAKOVS, J. et al. The impact of humic substances as remediation agents to the speciation forms of metal in soil. APCBEE Procedia, v. 5, p. 192-196, 2013.
CANELLAS, L. P.; SANTOS, G. A. Humosfera: tratado preliminar sobre a química das substâncias húmicas. Disponível em: <http://www.uenf.br>. Acesso em: 06. jan. 2016.
CANELLAS, L. P.; SANTOS, G. A.; RUMJANEK, V. M.; MORAES, A.A. GURIDI, F. Distribuição da matéria orgânica e características de ácidos húmicos em solos com adição de resíduos de origem urbana. Revista Agropecuária Brasileira, v. 36(12), p. 1.529-1.538, 2001.
CANELLAS, L. P.; SANTOS, G. A.; SOBRINHO, M. B. A.; MORAES, A. A.; RUMJAMEK, V. Adsorção de Cu2+ e Cd2+ em ácidos húmicos extraídos de resíduos orgânicos de origem urbana. Revista Ciência Rural, v. 29(1), p. 21-26, 2009.
CHEN, Y.; GAT, P.; FRIMMER, F. H.; BRAUN, G.A. Metal biding by humic substances and dissolved organic matter derived from compost. Springer link, v. 69, p. 275-297, 2006.
COLES, C. A.; YOUNG, R. N. Humic acid preparation, properties and interactions with metals lead and cadmium. Engineering Geology, v. 85, p. 26-32, 2006.
COLOMBO, S. M. Isolamento, purificação e caracterização de substâncias húmicas isoladas de vermicomposto. Propriedades ácido-base e de complexação com íons Cu (II). Dissertação (Mestrado em Química). Instituto de Química, Universidade de São Paulo. São Paulo, 2005.
CONCEIÇÃO, L. D. H. C.; SERENO, M. J. C. M.; NETO, J. F. B. Tolerância ao alumínio em plantas: toxicidade, mecanismos e genes em espécies cultivadas. Revista Brasileira de Agrociência, v. 13(3-4), p. 01-10, 2008.
COSTA, E. M.; SILVA, H. F.; RIBEIRO, P. R. A. Matéria orgânica do solo e o seu papel na manutenção e produtividade dos sistemas agrícolas, Enciclopédia Biosfera, v. 9(7), p. 1.842-1.860, 2013.
FILHO, A. V.; SILVA, M. I. V. Importância das substâncias húmicas para a agricultura. Disponível em: http://audienciapublica.ana.gov.br. Acesso em 06. jan. 2016.
FONTANA, A. Fracionamento da matéria orgânica e caracterização dos ácidos húmicos e sua utilização no sistema brasileiro de classificação de solos. Tese (Doutorado em Ciência do Solo). Instituto de Agronomia, Universidade Federal Rural do Rio de Janeiro. Seropédica, 2009.
GARCÍA, A. C. Frações sólidas humificadas de vermicomposto: seus efeitos em plantas e capacidade para a retenção de metais pesados. Tese (Doutorado em Ciências). Instituto de Agronomia, Universidade Federal Rural do Rio de Janeiro. Seropédica, 2013.
HOTZCLAW, K. M.; KEECH, D. A.; PAGE, A. L.; SPOSITO, G.; GANJE, T. J.; BALL, N. B. J. Environ Qual. Madison, v. 7, p. 124-127, 1978.
LÓPEZ, R. H. et al. Propiedades químicas y química-físicas de derivados estructurales de ácidos húmicos obtenidos de vermicompost. Actividad biológica. Revista Ciencias Técnicas Agropecuárias, v. 2(22), p. 55-60, 2013.
MARTINS, C. A. S.; NOGUEIRA, N. O.; RIBEIRO, P. H.; RIGO, M. M.; CANDIDO, A. O. A dinâmica de metais traço no solo. Revista Brasileira de Agrociencia, v. 17(3-4), p. 383-391, 2011.
MIGUEL, P. S. B.; GOMES, F. T.; ROCHA, W. S. D.; MARTINS, C. E.; CARVALHO, C. A.; OLIVEIRA, A. V. Efeitos tóxicos do alumínio no crescimento das plantas: mecanismos de tolerância, sintomas, efeitos fisiológicos, bioquímicos e controles genéticos. CES revista, v. 24, p. 13-29, 2010.
MIKKELSEN, R. L. Humic materials for agriculture, Better Crops, v. 89(3), p. 6-10, 2005.
MOTHÉ, G. P. B. Capacidade fotossintética e crescimento de dois genótipos de Ricinus communis L. em resposta a doses de material sólido particulado à base de ferro aplicados ao solo. Dissertação (Mestrado em Genética e Melhoramento de Plantas). Centro de Ciências e Tecnologias Agropecuárias, Universidade Estadual do Norte Fluminense. Campos dos Goytacazes, 2012.
NOVOTNY, E. H. Estudos espectroscópicos e cromatográficos de substâncias húmicas de solos sob diferentes sistemas de preparo. Tese (Doutorado em Ciências - Físico Química). Instituto de Química de São Carlos, Universidade de São Paulo. São Carlos, 2002.
OLIVEIRA, E. A. B. Avaliação de método alternativo para extração e fracionamento de substâncias húmicas em fertilizantes orgânicos. Dissertação (Mestrado em Agricultura Tropical e Subtropical). Instituto Agronômico de Campinas. Campinas, 2011.
POMBO, L. C. A. Absorção de metais pesados por plantas e métodos de avaliação da disponibilidade de cádmio no solo. Tese (Doutorado em Ciência do Solo). Faculdade de Agronomia, Universidade Federal do Rio Grande do Sul. Porto Alegre, 1992.
SANTOS, N. M. et al. Biodisponibilidade de chumbo por extratores químicos em solo tratado com ácidos húmicos e carvão ativado. Revista Ciência Agronômica, v. 4(46), p. 663-668, 2015.
SHIRIVER, P. F.; ATKINS, P. W. Química inorgânica. 3ª ed. Porto Alegre: Bookman, 2003.
STEVENSON, F. J. Humus chemistry: genesis composition, reactions. New York: John Willey, 1994.
VAZ, D. O. Estudo das interações de íons metálicos divalentes com ácidos fúlvicos extraídos das águas do Rio Suwanee. Tese (Doutorado em Química). Centro de Ciências Físicas e Matemáticas, Universidade Federal de Santa Catarina. Florianópolis, 2006.
VETROVA, O. V.; KONOVALOV, K. B. GAVRILENKO, M. A. Application of humic sorbents for Pb2+, Cu2+ and Hg2+ íons preconcentration from aqueus solutions. Procedia Chemistry, v. 10, p. 120-126, 2014.
WHITBY, H.; VAN DER BERG, C. M. G. Evidence for copper-binding humic substances in seawater. Journal Marine Chemistry, v. 173, p. 282- 290, 2015.
WOLTHER, R. C. D. Prognóstico da toxidez de ferro em arroz irrigado por alagamento através da análise de solo pelo método oxalato de amônio. Dissertação (Mestrado em Ciências). Faculdade de Agronomia Eliseu Maciel, Universidade Federal de Pelotas. Pelotas, 2010.
YEL, E.; AHMETLI, G. Enviromental dilemma of humic substances: being absorbents and being carcinogens. International Journal of Evironmental Science and Developments, v. 1(6), p. 73- 76, 2015.
Publicado em 27 de junho de 2016
Novidades por e-mail
Para receber nossas atualizações semanais, basta você se inscrever em nosso mailing
Este artigo ainda não recebeu nenhum comentário
Deixe seu comentárioEste artigo e os seus comentários não refletem necessariamente a opinião da revista Educação Pública ou da Fundação Cecierj.

