Carbono: fundamental para a vida
Alexandra Maria da Silva
Graduada em Ciências Físicas e Biológicas e Farmácia (UBM-BM), professora SES/RJ
Um ecossistema é uma comunidade contendo distintas espécies e o seu meio ambiente físico, no qual a energia flui e os elementos químicos se processam e são reciclados (Botkin, 2011).
Um ciclo biogeoquímico é a trajetória completa que uma substância ou um elemento químico realiza por meio de quatro principais componentes ou reservatórios do sistema terrestre: a atmosfera, a hidrosfera (oceanos, rios, lagos, águas subterrâneas e geleiras), a litosfera (rochas e solos) e a biosfera (plantas e animais).
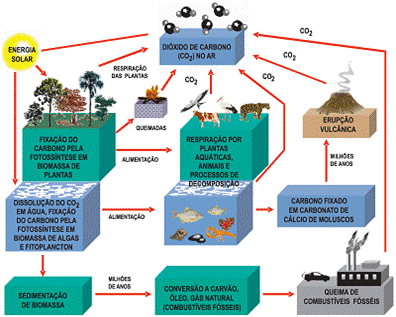
Figura 1 – Ciclo do carbono
O carbono é o elemento fundamental na formação dos compostos orgânicos, componente básico dos carboidratos, lipídios, proteínas, DNA e outras substâncias.
Apesar de ser imprescindível para a vida, o carbono não é um dos elementos químicos mais abundantes na crosta da Terra. Ele constitui apenas 0,032% do peso da crosta, posição distante do oxigênio (45,2%), silício (29,2%), alumínio (8,0%), ferro (5,8%), cálcio e magnésio (2,8%), segundo Botkin (2011).
Na atmosfera, o processo principal é a carbono foto-oxidação (OX), que gera dióxido de carbono (CO2) ou monóxido de carbono (CO).
Na litosfera, os principais processos são a fixação de dióxido de carbono por plantas, respiração, decomposição da matéria orgânica e por bactérias de levedura, que produz o metano (CH4) e dióxido de carbono (Jacson, 1996).
A maior quantidade de carbono na Terra é armazenada em rochas sedimentares dentro da crosta do planeta. Ele é produzido nas rochas, com o endurecimento de lama (que contém matéria orgânica) em xisto ao longo do tempo geológico ou por particulas de carbonato de cálcio a partir de conchas e esqueletos de organismos marinhos em calcário e outros.
Após a precipitação, a água dentro do solo promove o escoamento do carbono, e a água em contato com pedras promove intempéries de carbono inorgânico, fornecendo uma entrada de carbonatos para a hidrosfera (Langman e colaboradores, 2009).
O carbono inserido no oceano por simples difusão apresenta-se de inúmeras formas inorgânicas, o que inclui o dióxido de carbono dissolvido como carbonato e bicarbonato; existe também em compostos orgânicos de organismos marinhos e de seus derivados, como as conchas (COELHO, 2000).
Nos rios o carbono do solo é transportado para os oceanos, na forma de carbono dissolvido em partículas orgânicas; os ventos também transportam pequenos particulados orgânicos dos continentes para os oceanos.
Em termos de reações químicas, o dióxido de carbono possui baixa reatividade, tanto por sua baixa concentração na atmosfera quanto pela baixa reatividade fotoquímica. A única reação fotoquímica que o CO2 sofre é sua fotodissociação pela radiação ultravioleta na estratosfera (Langman e colaboradores, 2009).
Por esse motivo, o tempo de permanência de uma molécula de CO2 no ar é algo bastante indeterminado; uma vez emitido no ar, o destino de uma molécula de CO2 pode ser sua absorção resultante da colisão com superfícies líquidas (oceanos, rios etc.) ou fixação em plantas, decorrente de processos de fotossíntese. Entretanto, o CO2 estocado nas plantas é novamente liberado no ar como resultado de queimadas, manejo do solo e desmatamento, reiniciando o ciclo (Baird, 2011). Existem grandes quantidades de carbono imobilizadas sob a forma de rochas calcárias na crosta terrestre (Coelho, 2000).
O CO2 é proveniente principalmente da queima de combustíveis fósseis, desmatamento de florestas (que atuam como estoques naturais de carbono), acompanhado da queima e degradação da biomassa, e ainda por difusão dos oceanos (Ramanathan, 2009). E é removido por fotossíntese das plantas, num processo que transforma a energia proveniente da luz solar em energia química. São combinados dióxido de carbono e água para dar origem aos compostos orgânicos (Miller, 2007). Os produtores terrestres removem o CO2 da atmosfera; os aquáticos o removem da água. Pela respiração aeróbica, são quebrados a glicose e outros compostos orgânicos complexos e convertido o carbono novamente em CO2 na atmosfera ou na água para ser reaproveitado pelos produtores (Miller, 2007).
Essa junção de fotossíntese e respiração aeróbica nos produtores, consumidores e decompositores faz o carbono circular na atmosfera (Miller, 2007).
Nas escalas de tempo mais curtos, de segundos a minutos, as plantas absorvem o carbono fora da atmosfera pela fotossíntese e o libera de volta para a atmosfera pela respiração. Em escalas de tempo mais longos, de carbono a partir de material vegetal morto, pode ser incorporado aos solos, onde pode permanecer por anos, décadas ou séculos.
Alguns átomos de carbono levam um longo tempo para se reciclar.
Com a morte dos organismos, sua maior parte orgânica se decompõe em compostos inorgânicos, incluindo o dióxido de carbono. Em locais onde há temperaturas frias e ausência de oxigênio, certa quantidade de oxigênio pode ser enterrada e torna possível sua decomposição. Assim a matéria orgânica é armazenada (Botkin, 2011).
Durante milhões de anos, depósitos enterrados de matéria de plantas mortas são comprimidos com outras substâncias que se tornarão rochas sedimentares. Esse carbono é transformado em combustíveis fósseis, como gás natural, petróleo e carvão. A maior parte deles está na forma de carbonatos, como calcário, com origem biológica direta.
Esse carbono não é liberado para a atmosfera em forma de CO2 para a reciclagem; é preciso que ele seja extraído e queimado ou naturalmente por exposição a processos geológicos. E em períodos muito curtos eles são extraídos e queimados o que levou milhares de anos para se formar. Eis a razão por que esses combustíveis não são recursos renováveis na escala de tempo humana (Miller, 2007).
O ciclo do carbono é um dos influenciados por atividades antropogênicas (Coelho, 2000). O consumo acelerado dos combustíveis fósseis, juntamente com a diminuição das plantas verdes a retirar o CO2, está aumentando a sua concentração na atmosfera; nem a vegetação fotossintética da terra nem o sistema carbonato do mar tendem a manter estável o teor de CO2 na atmosfera (Rocha, 2004).
O ciclo de carbono desempenha um papel chave na regulação do clima terrestre, controlando a concentração de dióxido de carbono na atmosfera. O dióxido de carbono (CO2) é importante porque contribui para o efeito estufa, em que o calor gerado a partir da luz solar na superfície da Terra é capturado e impedido de escapar pela atmosfera. As moléculas de CO2 presentes no ar (nas concentrações atuais) absorvem muita radiação infravermelha (Baird, 2011).
O efeito estufa em si é um fenômeno perfeitamente natural; sem ele, a Terra seria um lugar muito mais frio. Mas um acúmulo anormal de gases de efeito estufa pode levar o planeta a ficar anormalmente quente.
Nos últimos anos, o CO2 tem recebido muita atenção porque a sua concentração na atmosfera subiu para cerca de 30% acima dos níveis naturais. Análises do gelo coletado nos polos da Terra indicam que as concentrações de CO2 e CH4 há 300 anos eram de 260 e 0,70 ppm, respectivamente. Os níveis mais atuais chegam a 379 e 1,774 ppm (ano-base 2005), a maior parte contribuição dos últimos 100 anos de atividades antropogênicas decorrentes principalmente de atividades como manejo e uso do solo e florestas. O gás metano está associado à degradação microbiológica da matéria e também é um dos gases do efeito estufa (Langman e colaboradores, 2009).
A manutenção de uma quantidade constante de CO2 na atmosfera ajuda a manter
temperaturas médias estáveis na escala global.
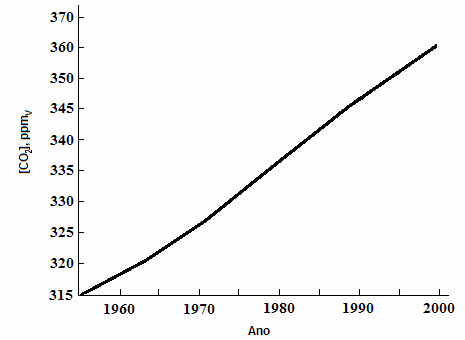
Figura 1 – Níveis de concentração do CO2 nas últimas décadas.
Fonte: Adaptado de Manahan (2001b).
Referências
BAIRD, Colin; CANN, Michael. Química ambiental. 4ª ed. Porto Alegre: Bookman, 2011.
BOTKIN, D. B.; KELLER, E. A ciência ambiental: Terra, um planeta vivo. 7ª ed. Rio de Janeiro: LTC, 2011, p. 293-296.
COELHO, R. M. P. Fundamentos em ecologia. Porto Alegre: Artmed, 2000.
JACSON, A. R. W.; JACSON, J. M. Environmental Science. The natural environment and human impact. Harlow: Longman, 1996. p. 1–370.
LANGMANN, B.; DUNCAN, B.; TEXTOR, C.; TRENTMANN, J.; WERF, G. V. Atmospheric environment, v. 43, p. 107-116, 2009.
MANAHAN, S. E. Fundamentals of Environmental Chemistry: Inorganic air pollutants. Boca Raton: CRC Press LLC. 2001b.
MILLER JR., G. Tyler Ciência Ambiental 11ª ed. São Paulo: Cengage Learning, 2013, p. 466-467.
RAMANATHAN, V.; FENG, Y. Atmospheric environment, v. 43, p. 37-50, 2009.
ROCHA, J. C.;ROSA, A. H.;CARDOSO, A. A. Introdução à química ambiental. Porto Alegre: Bookman, 2004. p. 70-72.
SCHLESINGER, W. H.; ANDREWS, J. A. Soil respiration and the global carbon cycle. Biogeochemistry, v. 48, p. 7–20, 2000.
Publicado em 25 de outubro de 2016
Novidades por e-mail
Para receber nossas atualizações semanais, basta você se inscrever em nosso mailing
Este artigo ainda não recebeu nenhum comentário
Deixe seu comentárioEste artigo e os seus comentários não refletem necessariamente a opinião da revista Educação Pública ou da Fundação Cecierj.

