Breve estudo da degradação da dioxina por meio da radiação ultravioleta
Alaíde de Sá Barreto
Doutora em Química (UFRJ)
Aline Santos Martins
Mestranda em Ciência e Tecnologia Ambiental (UEZO)
Viviane de Lima Noronha
Mestre em Ciência e Tecnologia Ambiental (UEZO)
Substâncias tóxicas persistentes
As substâncias tóxicas persistentes (STP) possuem alto teor de toxicidade; são formadas por compostos orgânicos que compreendem os poluentes orgânicos persistentes (POPs) e os metais pesados; estes são classificados, de acordo com Nakano et al. (2015), como microcontaminantes ambientais: arsênio, chumbo, cádmio, mercúrio; e elementos essenciais e simultaneamente microcontaminantes: cromo, ferro e manganês.
O aumento das STP ocorreu mundialmente no século XX, devido às exigências da sociedade industrializada e ao seu crescimento, influenciando, por exemplo, o desenvolvimento da indústria e o aumento da fabricação de alimentos, gerando com isso um número considerável de substâncias tóxicas persistentes.
O ser humano é exposto aos POPs por meio da alimentação, de acidentes e da poluição ambiental. Essa exposição se dá com maior frequência pela alimentação (Félix et al., 2007). Estudos em amostras de leite materno realizados em diversas partes do mundo revelaram-se extremamente preocupantes (Saleh et al., 1996).
Os poluentes orgânicos persistentes causam grandes danos ambientais por possuírem características que, mesmo em pequenas proporções, prejudicam a saúde do ser humano, provocando doenças como o câncer e a má-formação de humanos e animais, alergias e hipersensibilidade, além de doenças do sistema nervoso central e periférico (Félix et al., 2007), e afetando os ecossistemas. De acordo com Centeno et al. (2007), essas características podem ser classificadas como alta hidrofobicidade (capacidade de umectabilidade), baixa reatividade no meio ambiente; possuem grande tendência de para se acumular nos tecidos dos organismos vivos (bioacumulativo) e se concentrar em e magnificar nesses organismos e ao longo da cadeia alimentar (bioconcentração e biomagnificação, respectivamente), além da resistência à imutabilidade e à degradação química. As STP são liberadas no meio ambiente em detritos provenientes de produção industrial, por ação do ser humano sobre o meio ambiente ou pela utilização de agrotóxicos.
Em 2001, na Suécia, foi assinado por 90 países, inclusive o Brasil, o primeiro tratado internacional, conhecido como Convenção de Estocolmo, que objetivou a eliminação dos POPs no mundo. No tratado, os POPs, também denominados “os doze sujos”, são os seguintes compostos, de acordo com Nass & Francisco (2012): aldrin, clordano, mirex, dieldrin, DDT, dioxinas (PCDDs – policlorodibenzo-p-dioxinas), furanos (PCDFs), bifenilas policloradas (PCBs), endrin, heptacloro, hexaclorobenzeno (HCB) e toxafeno. Atualmente, o tratado está assinado por 159 países e defende, dentre outras coisas (Braga, 2003): obrigatoriedade de financiamento dos países desenvolvidos para os países em desenvolvimento; a eliminação dos POPs produzidos intencionalmente, existentes e novos; o banimento gradativo do pesticida DDT e dos agrotóxicos PCBs. Ainda segundo o autor, o quinto artigo do tratado dispõe sobre um plano de ação que tem como meta a identificação, a caracterização e a localização de fontes emissoras de PCDDs, furanos e PCBs.
Atualmente, pelo projeto Avaliação Regional das Substâncias Tóxicas Persistentes, implantado pelo Unep (Programa das Nações Unidas para o Meio Ambiente), que visa avaliar, identificar e minimizar os impactos das substâncias mais danosas encontradas em doze regiões ao redor do mundo, os POPs foram desmembrados em três grupos: agrotóxicos, compostos industriais e subprodutos não intencionais. As dioxinas (PCDDs) e os furanos fazem parte dos grupos dos subprodutos não intencionais; DDT, aldrin, dieldrin e hexaclorobenzeno (HCB) constituem os grupos dos agrotóxicos; as bifenilas policloradas (PCBs) formam o grupo compostos industriais.
De acordo com Centeno et al. (2007), a versão do documento na América do Sul, Regionally Based Assessment of Persistent Toxic Substances – Eastern and Western South America Regional Report, os POPs também são classificados por classes de prioridade, que visam à toxicologia, aos níveis ambientais e aos efeitos à saúde humana de cada substância. O DDT é classificado como uma das substâncias de maior prioridade, constituindo assim a classe I.
Segundo Nass & Francisco (2012), a maioria dos POPs já foi eliminada ou reduzida por quase todo o mundo, mesmo em países que só importam alguns poluentes orgânicos persistentes, como no caso do Brasil, para fins industriais. Contudo, os policlorodibenzo-p-dioxinas e os furanos demorarão mais para ser eliminados ou reduzidos consideravelmente, por serem compostos químicos produzidos não intencionalmente.
Dioxinas e seus efeitos à saúde no Brasil e no mundo
As dioxinas (ou PCDDs - policlorodibenzo-p-dioxinas) são substâncias tóxicas persistentes organocloradas bioacumulativas, por onde ocorrem a biomagnificação; classificadas como subprodutos não intencionais, são produção, sobretudo da indústria, em particular no século XX, que ocorre por meio do emprego ou na combustão do cloro juntamente com matéria orgânica, como na madeira contaminada por pentaclorofenol, na incineração de lixo (municipal, médico, aterros sanitários etc.), na produção de polpa e papel, na queima de pneu, na produção do plástico PVC (cloreto de polivinila ou vinil) – do qual é considerado o maior produtor mundial de dioxina, pois é um material que possui cloro em sua formação e, quando incinerado, ocorre a formação de dioxinas (Portal São Francisco, 2015; AOCP, 2015). Mundialmente, mais de 3% da produção de dioxina ocorre por meio da queima da madeira corrompida por materiais clorados ou pesticidas (Greenpeace, 1996).
Há 75 tipos diferentes de dioxinas, todas constituídas de anéis benzênicos, átomos de cloro e de oxigênio. Dentre as dioxinas, se destaca a 2,3,7,8 – tetraclorodibenzo-p-dioxina ou (2,3,7,8 – TCDD), por sua alta toxicidade, quando comparada com as demais dioxinas (Figura 1).
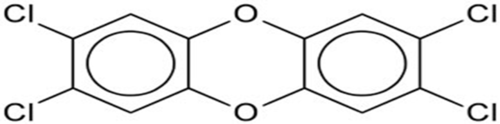
Figura 1: 2,3,7,8 – tetraclorodibenzo-p-dioxina.
Fonte: Portal São Francisco (2015).
Durante o processo de preparação do herbicida 2,4,5 – T (ácido 2,4,5 – triclorofenoxiacético), ocorre a formação de dioxina 2,3,7,8-tetraclorodibenzo-p-dioxina como constituinte minoritário. Em 1980, a produção do herbicida 2,4,5 – T foi extinguida (Baird et al., 2011), pois durante a sua síntese ocorria a formação da 2,3,7,8-tetraclorodibenzo-p-dioxina. Ainda de acordo com os autores, hoje a contaminação do herbicida 2,4,5 – T pela dioxina pode ser minimizada conservando a concentração de dioxina abaixo de 0,1 ppm[1].
A contaminação por dioxina pode ocorrer, por exemplo, via alimentos que tiveram contato com ela e via respiração de gases oriundos da incineração. Com isso, a União Europeia e a Organização Mundial da Saúde instituíram, como limite máximo, a dosagem de 2,3pg/kg/dia[2]. Entretanto, a American Enviromental Protection Agency (EPA) estabeleceu como limite tolerável a quantidade de 0,7pg/kg/dia, o que poderia representar, por exemplo, o filtro de papel utilizado como coador de café (feito com papel branqueado industrialmente) (Ecycle, 2015).
A emissão de dioxinas é considerada grave, até em pequenas quantidades, devido à sua capacidade de se bioacumular. Estudos realizados no Canadá mostraram que são emitidos pelo ar, anualmente, cerca de 58,7kg de dioxina por meio de queimadas de florestas. E, que 1mg de dioxina é capaz de matar a metade dos macacos com peso de 15kg (Nass; Francisco, 2012). De 1987 até 1995, a emissão de dioxina nos Estados Unidos diminuiu 75%. Tal feito se deve, dentre outras coisas, à diminuição da emissão de dioxina via incineração de lixo municipal e médico (Baird et al., 2011). Perlatti (2012) adverte que, na combustão de resíduos químicos a uma temperatura entre 250ºC e 400ºC, acontece a maior formação de dioxinas.
De acordo com o United Nations Environmental Programme (Unep) (2002), o Brasil e a Argentina foram apontados como os responsáveis por 45% de emissão de dioxina na América do Sul (Incciencia, 2014).
Com relação à ingestão de alimentos contaminados por dioxina, segundo a Organização Mundial da Saúde (2015), mais de 90% da exposição dos seres humanos à dioxina ocorrem pela alimentação com carnes, laticínios, peixes e mariscos. Desses alimentos, para um norte-americano, 31,8% acontecem com a carne de vaca, de acordo com a Usepa[3] (1994). Estudos realizados pelos pesquisadores Beck et al. (1992) mostraram que nos Estados Unidos um bebê recém-nascido que se alimenta com 800mL de leite diariamente consome em média 147pg EQT-I/kg mc[4]. Com esses dados, a concentração de dioxina em gorduras de leite mostrou ser maior do que em gorduras de outros alimentos.
No Canadá, pesquisas com o leite humano entre 1992 e 2005 constaram redução considerável de contaminação por dioxina, incluindo a 2,3,7,8-tetraclorodibenzo-p-dioxina (2,3,7,8 – TCDD), o que foi relacionado a uma diminuição da exposição do ser humano aos POPs (Ryan et al., 2014). Tal redução está relacionada às alternativas de diminuição da contaminação de dioxina pelos seres humanos sugeridas pela OMS, quais sejam, consumo de leite desnatado, remoção da gordura em carnes e aves, inclusão de uma dieta saudável (Incciencia, 2014).
No Brasil, pesquisas realizadas no Estado de Minas Gerais comprovaram níveis de contaminação por dioxina em ovos de galinhas na concentração de 1,8pg TEQ[5]/grama de gordura, o que é considerado um alto nível de contaminação por dioxina (Nacif, 2014).
Quanto às evidências ou especulações a respeito dos danos à saúde dos seres humanos e dos animais provocados pelo contato com as dioxinas, estudos de Schecter et al. (2006) citam algumas doenças que podem ser causadas por dioxina: câncer, imunodeficiência, anormalidade no desenvolvimento e diabetes. Tais manifestações clínicas foram corroboradas em pesquisas de autores como Peper et al. (1993) e Fingerhut et al. (1991); a maioria deles considerou uma conexão entre o tempo de meia-vida da dioxina, cerca de 7,2 anos, e essas doenças.
O herbicida 2,4,5 – T é um herbicida fenóxi, composto por fenol e anel benzênico que possui átomos de cloro. Esse herbicida foi inserido no comercio para o combate às ervas daninhas no final da Segunda Guerra Mundial (Baird et al., 2011). Com toxicidade moderada, esse composto é quase sempre utilizado para a eliminação de matos. Quando combinado com o herbicida fenóxi 2,4 - D (ácido 2,4-diclorofenoxiacético), das classes dos herbicidas fenóxi, um dos herbicidas mais utilizados no mundo devido ao baixo custo de produção e é empregado no combate de ervas daninhas na agricultura e em uso doméstico (Baird et al., 2011), temos o chamado Agente Laranja, que foi largamente utilizado na Guerra do Vietnã pelo exército dos EUA. A sua preparação inadequada ocasionou a contaminação ambiental pela dioxina. Estudos apontaram que a exposição dos vietnamitas à vegetação contaminada por dioxina pode ser a causadora de doenças como câncer, doenças respiratórias e abortos espontâneos, que surgiram após essa exposição. Exames mais específicos não comprovaram essa hipótese, contudo o estudo corroborou que subprodutos da dioxina podem ser os causadores das enfermidades (Welle, 2015).
Braga (2003) observou que a dioxina 2,3,7,8 – TCDD é uma grande causadora de câncer em animais como ratos, camundongo e cobaias. E que, quando comparados os dados sobre câncer desses animais com os dos humanos, constata-se que houve avanço no número de casos de tumores de tireoide e pulmonar em humanos e em ratos. Relatórios da Usepa (1995), com base em diversos estudos no gênero, informaram que, com relação aos tumores malignos, as evidências que se tem mostram que a dioxina 2,3,7,8 – TCDD pode provocar câncer e que as demais dioxinas não deveriam ser classificadas como causadoras de câncer, por não o serem. Contudo, por exposição contínua do ser humano e dos animais aos diversos POPs, ainda é difícil concluir com exatidão qual é a relação das 2,3,7,8 – TCDD com o aumento de incidência de tumores.
A radiação ultravioleta e os métodos fotoquímicos
A radiação eletromagnética é uma fonte de energia transportada a velocidades muito altas pelo espaço (Skoog et al., 2007). Ela é comumente classificada pela frequência de uma onda característica para cada tipo de energia. A classificação da radiação eletromagnética em função de seu efeito físico leva à construção de um espectro eletromagnético que abrange desde raios gama até as ondas de rádio, conforme a Figura 2.
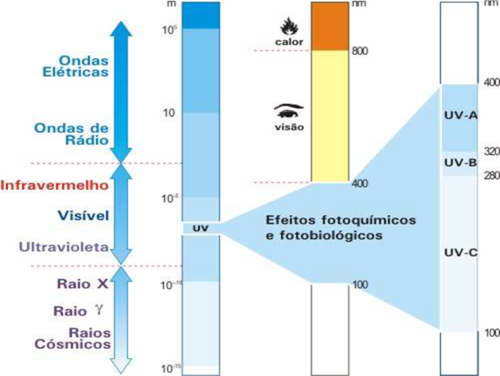
Figura 2: Os comprimentos de onda do espectro eletromagnético (onde SI, nanômetro: 1nm = 1 x 10-9 m).
Fonte: INPE (2015).
A radiação ultravioleta é a parte do espectro eletromagnético que compreende os comprimentos de onda que variam entre 100 e 400 nanômetros. Pode-se considerar que a maior parte da energia radiante do sol está concentrada nas partes visível ou próximo da visível do espectro, pois a luz visível corresponde a aproximadamente 44% do total emitido, 37% estão no infravermelho próximo, 11% no infravermelho, 7% no ultravioleta e menos de 1% da radiação solar é emitida como raios-X, raios gama, micro-ondas, ondas de rádio (Atkins; Jones, 2001).
A faixa do espectro eletromagnético referente à radiação ultravioleta pode ser subdividida em ultravioleta de vácuo – UVV (100-200nm), ultravioleta distante (200-300nm) e ultravioleta próximo (300-400nm). Os fótons nessas faixas de comprimento de onda têm efeitos diferentes sobre a matéria. Normalmente, essa faixa é classificada em três outros tipos de radiação: UV-A (luz negra), UV-B (luz eritematogênica) e UV-C (luz germicida). A radiação UV-A e a UV-B atingem a superfície terrestre a partir da emissão solar; a primeira acontece em maior quantidade, enquanto a radiação UV-C é totalmente absorvida pelo ozônio estratosférico. A radiação UV-B é a causadora de danos à saúde dos seres humanos, como lesões e câncer de pele (Moraes, 2003). A radiação UV-A é o principal tipo de radiação UV que atinge a biosfera a partir da emissão solar, sendo considerada como maior fração dos outros componentes do espectro de UV é refletida ou absorvida pela camada de ozônio presente na estratosfera.
Quadro 1: Comprimento do espectro eletromagnético e características da radiação UV
| Radiação | Intervalo espectral em (nm) | Características |
|---|---|---|
| UVC | 100 - 280 | Completamente absorvida pelo oxigênio e ozônio estratosférico e, portanto, não atinge a superfície terrestre. É utilizada na esterilização de água e materiais cirúrgicos. |
| UVB | 280 - 320 | Fortemente absorvida pelo ozônio estratosférico. É prejudicial à saúde humana, podendo causar queimaduras e, a longo prazo, câncer de pele. |
| UVA | 320 - 400 | Sofre pouca absorção pelo ozônio estratosférico. É importante para sintetizar a vitamina D no organismo. Porém o excesso de exposição pode causar queimaduras e, a longo prazo, causar o envelhecimento precoce. |
A descoberta do raio ultravioleta teve sua teoria desenvolvida em 1864 e tem como princípio as ondas eletromagnéticas compostas por dois tipos de campos – magnético e elétrico –, onde se propagam no vácuo transportando energia; a partir disso, podemos afirmar que a luz é considerada uma radiação eletromagnética.
A teoria eletromagnética foi desenvolvida pelo escocês James Clerk Maxwell durante o século XIX; ele demonstrou que os campos elétricos e magnéticos se propagam com a velocidade da luz, hipótese que mais tarde foi confirmada pelo físico alemão Heinrich Hertz. No final do século XIX, o cientista alemão Johan Ritter percebeu que os raios de sol, logo após o limite de visibilidade do olho humano (raios invisíveis), eram capazes de oxidar haletos de prata. Com essa descoberta observou-se o escurecimento dos sais de prata quando expostos à luz do sol (radiação), que a princípio eram chamados de raios desoxidantes, devido à sua reatividade química; posteriormente, foram denominados luz ultravioleta. No mesmo século, o físico alemão Albert Einstein elucidou o efeito fotoelétrico como sendo o efeito que corresponde à emissão de elétrons por um material, geralmente metálico, quando exposto a uma radiação eletromagnética de frequência suficientemente alta, teoria verificada em 1887 por Hertz.
A radiação solar
A radiação solar é um espectro eletromagnético contínuo, constituída basicamente pelo infravermelho, pela parte visível e pelo ultravioleta. É essencial para a vida no nosso planeta, permitindo o seu aquecimento, além da realização da fotossíntese.
A parte visível (ou luz visível), à qual o olho humano é sensível, possui comprimento de onda λ, entre 0,7μm[6] e 0,4μm. Por causa de um intervalo consideravelmente pequeno, o espectro de luz visível ocorre do violeta até o vermelho. Sua condução acontece em uma unidade conhecida como fóton ou quanta (Acervo Saber, 2015). A energia do fóton depende do comprimento λ.
A radiação solar como fonte de energia só encontrou utilidade no aquecimento de água, devido ao seu alto custo, que acaba tornado-a economicamente inviável (Moraes, 2003). Ainda de acordo com o autor, as soluções para esse problema estariam no processo de captura da radiação solar e na sua conversão em energia armazenável.
A energia oriunda da radiação solar ou qualquer outro tipo de energia radiante absorvida por moléculas ou átomos interfere no crescimento dessas moléculas e em sua temperatura.
A radiação ultravioleta artificial
A radiação ultravioleta artificial geralmente é gerada por lâmpadas. Segundo Queiroz (2011), o processo de energia pela emissão de radiação eletromagnética ocorre por meio da excitação das moléculas de gás, que acontece depois uma descarga elétrica.
As lâmpadas de vapor de mercúrio e xenônio são as mais comercializadas. A lâmpada de vapor de mercúrio age com baixa, média e alta pressão. São mais utilizadas que as de vapor, por serem mais luminosas e apresentarem maior tempo de vida útil, cerca de 3 a 5 anos ou 20.000 horas em condições normais de uso (Wakabayashi et al., 2007). Ela consegue alcançar picos de 254, 263, 297, 303 e 365nm, desde espectros ultravioletas aos espectros de infravermelhos.
Entre as suas desvantagens estão: as lâmpadas que atuam em baixa pressão emitem baixa irradiação entre seus picos de emissão (Neyens et al., 2003); o risco ambiental, devido aos teores de metais pesados tóxicos encontrados em seu eletrodo e em sua camada branca, serem superiores a 0,1mg.kg-1, conforme estabelecido pela Associação Brasileira de Normas Técnicas (ABNT) (Queiroz, 2011).
A lâmpada de xenônio emite um espectro eletromagnético bem parecido com o da radiação solar, podendo ser considerada um excelente simulador solar. O gás dentro do invólucro de quartzo concentra-se a uma pressão entre 20 e 40atm (Neyens; Baeyens, 2003). Contudo, necessita de um comprimento maior de ultravioleta, além de ter irradiação reduzida e necessitar de ajustes constantemente (Queiroz, 2011). Ainda de acordo com Queiroz (2011), o amplo custo energético exigido para uma grande quantidade de UV, anexo às dificuldades de penetração da energia que incide, acaba por vezes tornando essa fonte artificial inviável economicamente.
Os processos oxidativos avançados
Os processos oxidativos avançados (POAs) são definidos como sendo processos físico-químicos capazes de degradar compostos orgânicos e persistentes através da produção do radical hidroxila (·OH), que tem grande potencial de oxidação (2,8V) (Pereira, 2008; Moraes, 2003). O radical hidroxila pode reagir com diversos compostos, transformando-os em compostos inertes como CO2, H2O e ácidos minerais (Tafarel, 2007).
A geração do radical hidroxila ocorre geralmente utilizando combinação de ozônio, peróxido de hidrogênio (H2O2), fotocatálise heterogênea, radiação UV, ultrassom, irradiação com feixes de elétrons, dióxido de titânio (TiO2), que são classificados em sistemas homogêneos e sistemas heterogêneos com ou sem irradiação UV, (Nogueira; Jardim, 1998; Pereira, 2008). Esses métodos removem os contaminantes dos efluentes por meio de processos como adsorção, dessorção e separação com membranas, por meio de oxidantes fortes como ozônio e peróxido de hidrogênio; os POAs fazem a transformação deles em corpos inativos (Oppelander, 2003).
Os sistemas fotoquímicos são aqueles em estão compreendidos os sistemas homogêneos e heterogêneos com UV. Nesses sistemas ocorre a produção do radical hidroxila, por meio da quebra de ligações covalentes e o UV. Nesses sistemas, a utilização do UV é necessária, pois nem todos os compostos orgânicos são degradados somente com o ozônio ou o peróxido de hidrogênio, por exemplo, podendo causar toxicidade maior do que a inicial. A destruição desses compostos pode ser alcançada adicionando UV na reação (Munter, 2001).
Os sistemas de oxidação fotocatalíticos foto-fenton e UV/TiO2 são exemplos de sistemas fotoquímicos e serão detalhados a seguir. Segundo Baird (1999), uma maneira de obter os radicais hidroxila é por meio do uso de oxidantes ou semicondutores e UV. Este último pode ser por meio da luz solar, luz artificial, com lâmpadas. Na pesquisa de Momenti (2006), ele analisou diversos POAs juntamente com processo anaeróbico no tratamento de efluentes do processo industrial de branqueamento de polpa de celulose. Concluindo com o POA O3/UV houve aumento na biodegradabilidade dos compostos poluentes de 160%, comparado com os demais processos analisados. Na pesquisa de Silva (2007), a eficiência do foto-fenton na oxidação de poluentes do solo foi avaliada. No final da pesquisa, o POA se mostrou ser satisfatório. Mencionaremos nesta revisão o processo fotocatalítico UV/TiO2 e semicondutor; e o processo foto-fenton, juntamente com a irradiação solar e em sua forma artificial gerada por lâmpadas germicidas com o comprimento de onda de 250nm.
Sistema foto-fenton
Oxidação do tipo foto-fenton é um sistema homogêneo que ocorre quando íons de Fe3+ (peridóxico de hidrogênio e um sal de ferro) são acrescentados ao processo UV/H2O2. Isso acontece após a oxidação de Fe2+ em Fe3+, gerando radicais hidroxila – reação fenton, Moraes (2003). A reação em questão é fotocatalítica, donde o Fe2+ é sucessivamente regenerado (Cardenã, 2009). Os íons Fe3+ são reduzidos para Fe2+ pela exposição à radiação UV. Além de gerar HO•, equação 1 (Moraes, 2003).
Os radicais hidroxila gerados nas reações de fotólise começam a oxidação dos poluentes orgânicos (RH), equações 2 e 3 (Moraes, 2003),
A redução do Fe3+ para Fe2+ pode acontecer por meio da radiação solar (Moraes, 2003). De acordo com Coelho (2011) e Cardenã (2009), o sistema foto-fenton pode ocorrer com radiação visível de 410nm até 600nm (35% da radiação solar). Vários autores analisaram os resultados da aplicação da energia solar em processos fotoquímicos para o tratamento de efluentes. Podemos citar Bandara et al. (1996), que analisaram o desempenho do sistema foto-fenton exposto a lâmpadas que simulavam a radiação UV visível, em que obtiveram bons resultados com o processo. Moraes (2003) cita em sua pesquisa um trabalho em que o sistema foto-fenton e radiação UV visível se mostraram eficientes na degradação de corantes, na região visível. De acordo com Wu et al. (1999), o herbicida 2,4,5 – T, assim como diversos outros compostos aromáticos, podem ser degradados pelos sistemas Fe3+/H2O ou Fe2+/ H2O quando expostos à radiação UV visível. Segundo Moraes (2003), diversos tipos de efluentes podem ser totalmente oxidados ou ainda produtos menos nocivos ao meio ambiente. Segundo Cardenã (2009), um dos benefícios desse processo está nos custos econômicos e operacionais, que são bem inferiores quando comparados aos demais POAs.
Três fatores podem influenciar na eficiência do processo foto-fenton: o fator pH, íons ferrosos e férricos, concentração de peridóxico (Silva, 2007).
O fator pH influencia a eficiência da degradação dos compostos orgânicos, pela geração de hidroxila. Silva (2007) observou que, acima de 4, a degradação diminui, devido à precipitação do ferro em hidróxido. Tal fato foi confirmado por Nogueira et al. (2000), que observaram que a degradação diminui com pH acima de 3 e aumenta com valores de pH em torno de 3.
A velocidade do processo foto-fenton pode aumentar se a concentração de Fe/H2O2 aumentar (Cardenã, 2009).
Oxidação fotocatalítica UV/TiO2
A fotocatálise ou oxidação fotocatalítica é um processo de catálise usando fótons (Taffarel, 2007). Esse processo ocorre através de um semicondutor que absorve a energia dos fótons, agindo como catalisador produzindo radicais hidroxilas, que podem oxidar e transformar em minério os compostos orgânicos (Vieira et al., 1999).
Os catalisadores atuam em determinado espectro de radiação e podem estar suportados em uma suspensão, que é o caso da fotocatálise heterogênea, ou podem estar diluídos, que é o caso da fotocatálise homogênea, e têm como exemplo o processo foto-fenton (D’Avila, 2012).
A fotocatálise heterogênea é suscetível na degradação de compostos orgânicos poluentes, como fenóis, clorofenóis e herbicidas. Levando, na grande maioria das vezes, à completa mineração desses compostos, originando, CO2, H2O e íons de heteroátomo (Silva, 2007).
A fotocatálise heterogênea tem sido bastante investigada em matrizes aquosas e está se mostrando ser uma excelente tecnologia em degradação de contaminantes orgânicos persistentes. Seu estudo na descontaminação de poluentes teve início em 1983, com os autores Pruden e Ollis. Porém não há muitos estudos em matrizes sólidas (Silva, 2007; Taffarel, 2007).
A fotocatálise heterogênea demanda a ativação de um condutor, o qual geralmente é o TiO2 (dióxido de titânio), por luz solar ou artificial (Taffarel, 2007). Das vantagens que o TiO2 apresenta estão o baixo custo, pH mais estável, não toxicidade (Romero et al., 1999).
Na fotocatálise é realizada, primeiramente, a irradiação do catalisador de TiO2, por exemplo, gerando a fotoativação dele. Nessa etapa ocorre a absorção de fótons pelo catalisador com energia maior que a do bandgap – diferença de energia entre duas bandas, banda de valência (BV) e banda de condução (BC), ocorrendo com isso uma transição de elétrons (e-) da banda de condução para a banda de valência, provocando lacunas (h+) com altos potenciais positivos, numa faixa entre +2,0 a +3,5, na banda BV. Com a transição de elétrons, o fotocatalisador gera espaços (sítios) oxidantes e redutores. No entanto, é necessário que os comprimentos de onda não ultrapassem 400nm. A partir de moléculas de água adsorvidas na superfície do condutor, o potencial citado acima gera radicais hidroxilas – processo também conhecido como fotocatálise indireta – que oxidam o poluente (Queiroz et al., 2011; Vieira et al., 2011; D’Avila, 2012; Silva, 2007).
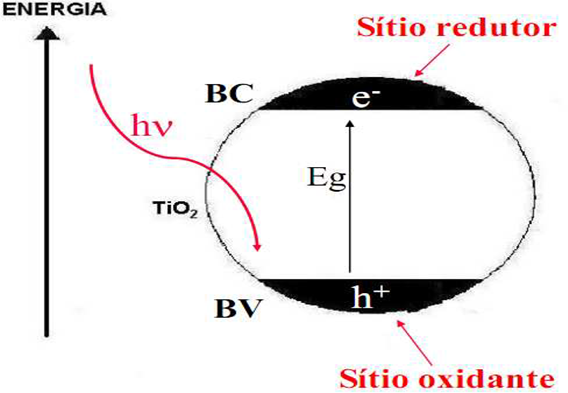
Figura 3: Fotocatalisador e a fotoativação
Fonte: Gumy et al. (2009).
A faixa de comprimento de onda citada admite o uso da radiação solar. Em termos econômicos, a temperatura ideal para um processo fotocatalítico é entre 20ºC e 80ºC (Taffarel, 2007).
A fotocatálise por luz solar, além de possibilitar a eliminação de compostos tóxicos resistentes, é bem econômica, pois utiliza energia limpa e abundante (Michael et al., 2012). Ainda segundo os autores, a fotocatálise por luz solar, quando combinada com tratamento efluente e águas já existentes, permite o uso por empresas de pequeno porte, ponto de vista ratificado por Goswami (1995).
A degradação de compostos orgânicos tóxicos persistentes por meio de processo fóto-fenton por luz solar também tem se tornado bem atrativo economicamente (Nogueira et al., 2007).
Reatores fotoquímicos
Para Taffarel (2007), para se desenvolver um reator com alta eficácia, pontos como a fonte de UV, a eficiência da iluminação e a cinética da reação devem ser bem observadas. Ainda segundo ele, um reator fotocatalítico pode ser classificado em diversas formas, como tipo de iluminação (artificial ou solar), forma de uso do catalisador (suspensão ou suportado), ou ainda a posição da fonte.
Os reatores fotoquímicos solares podem ser classificados em dois tipos: reatores concentrados e reatores não concentrados, segundo a intensidade de radiação. Os reatores concentrados são bem parecidos com os PTR – coletores térmicos com refletor parabólico, mas têm uma diferença, a exposição à radiação UV do fluido; para tanto, o absorvedor necessita ser transparente à radiação UV. A desvantagem desse reator é que ele não pode utilizar a luz difusa (Vieira et al., 1999). Ainda segundo os autores, isso se torna um problema, pois a fotocatálise com TiO2 utiliza uma parte direta da radiação UV que satisfaz a 4-6% do espectro total. Mas 50% da radiação UV concentram-se na forma difusa. Já os reatores não concentrados podem usar os dois tipos de radiação solar (direta ou difusa); por essa razão, acabam se tornando mais vantajosos que os concentrados.
Dentre os reatores fotoquímicos artificialmente temos o reator anular, que, de acordo com Taffarel (2007), tem dois tubos concêntricos e uma lâmpada UV dentro do tubo interno, transparente. É um dos reatores mais atrativos, por ser de fácil manipulação e trabalha muito bem com a irradiação.
Por mais que seja bem atrativo, a probabilidade de ter no processo fotocatalítico a radiação solar é bem pequena, pois somente 3% a 4% do fluxo solar chega à superfície terrestre para fotoativação do TiO2, menor que o comprimento de onda necessário para isso, entre 380nm e 390nm (Cassano; Alfano, 2000). Pesquisas como a de Queiroz (2011) analisam a melhor maneira de aproveitar o fluxo solar.
Resultados e discussões
A degradação da dioxina
Em trabalhos como os de Katsumata et al. (2006), observamos o uso do processo fóton-fenton em solução aquosa para a degradação das dioxinas PCDDs. Na pesquisa foi relatado que a quantidade de Fe2+ = 0 – 5,6mg.L-1, H2O2 = 0 – 3,4mg.L-1e a quantidade de radiação UV < = 300nm e PCDDs = 10ng.L-1. Os resultados obtidos pelos autores foram:
- Após 20 minutos: degradação completa de 2,3,7,8 - TCDD;
- Após 120 minutos: penta - para hexa - CDD foram completamente degradados;
- Após 300 minutos: degradação não completa de PCDD;
- As taxas de degradação diminuíram à medida que o número de cloros aumentou.
No trabalho de Trovo et al. (2005) notamos que o tratamento de herbicidas por meio do fóton-fenton resultou em uma degradação de 100%, tanto com o UV artificial quanto com o UV solar.
Já na pesquisa de Choi et al. (2000) é relatado o estudo da degradação fotocatalítica das PCDDs em filme TiO2 sob irradiação UV artificial ou solar, em suspensão aquosa. As taxas de degradação fotocatalítica das dioxinas PCDD diminuíram com o número de átomos de cloro, com velocidade da reação para dioxina 2,3,7,8 – TCDD de 0,71h. A destruição completa das dioxinas 2-clorodibenzo-p-dioxina e 2,7-dichlorodibenzo-pdioxina foi observada depois de 2h e 90h, respectivamente. As taxas de degradação aumentaram com a intensidade de luz e com a massa de revestimento do TiO2 de 2mW (megawatt)/cm2 em 300nm < λ <400nm e 200µg[7] de TiO2/cm2, respectivamente. Aumentos adicionais na intensidade da luz ou na massa de revestimento de TiO2 não afetaram tanto a degradação da taxa. Na degradação da dioxina PCDD em TiO2, a luz solar foi tão eficaz quanto a luz artificial, produzida por uma lâmpada de mercúrio de 200W, filtrada por um filtro de pirex. A degradação fotocatalítica da dioxina PCDD pode ter sido iniciada pelo ataque de radicais hidroxilas e não pela transferência da banda de condução dos elétrons. Assim, foi observado no geral que as dioxinas degradam com sucesso no processo de oxidação fotocalítica com TiO2.
Conclusões
Nos trabalhos que foram citados aqui é inegável a eficácia do sistema fotocatalítico combinado com o UV solar ou artificial para a degradação de compostos tóxicos persistentes. Dentre esses destacamos as dioxinas PCDD, que são compostos químicos, que mesmo em pequenas quantidades são considerados tóxicos (ou altamente tóxicos).
A fotocatálise heterogênea ou homogênea, com UV artificial ou solar, mostrou-se ser bastante eficaz na eliminação das dioxinas, assim como outros poluentes tóxicos. Entretanto, a quantidade de pesquisas envolvendo a problemática ainda é muito pequena para o enorme prejuízo trazido (diretamente ou indiretamente) por esses contaminantes.
Referências
ATKINS, P. W.; JONES, L. Princípios de Química: questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman, 2001.
BAIRD, C.; CANN, M. Química ambiental. 3ª ed. Porto Alegre: Bookman, 2011.
BRAGA, A. M. C. B. Dioxinas, furanos e PCBs em leite humano no Brasil. Disponível em: http://www.bibliotecadigital.unicamp.br/document/?code=vtls000376714&fd=y. Acesso em 01 nov. 2015.
D’AVILA, A. C. S. Degradação do pesticida amicarbozona em meio aquoso pelo processo TIO2/uV invadido por luz solar. São Paulo, 2012.
FELIX, F. F.; NAVICKIENE, S.; DÓREA, H. S. Poluentes orgânicos persistentes (POPs) como indicadores da qualidade dos solos. Revista da Fapese, v.3, nº 2, p. 39-62, jul./dez. 2007.
FINGERHUT, M. A.; HALPERIN, W. E. Cancer mortality in works exposed to 2,3,7,8, tehachlodibenzo-p-dioxin. 1991. Acesso em 11 nov. 2011.
GOSWAMI, D. Y. Engineering or solar photocatalytic detoxification and disinfections processes. Advances in solar energy, K. W. Boër. Ed, v. 10. American Solar Energy Society, Boulder, CO, p. 165- 209, 1995.
GREENPEACE. Efeitos dos organoclorados na saúde humana. 1996. Disponível em: http://www.geocities.com/RainForest/wetlands/8552/Grennpea.htm, Acesso em 28 nov. 2015.
KATSUMATA, H.; KANECO, S.; SUZUKI, T.; OHTA, K.; YOBITO, Y. Degradation of polychlorinated dibenzo-p-dioxins in aqueous solution by Fe (II)/H2O2/UV system, Chemosphere 63, p. 592–599, 2006.
NASS, D. P.; FRANCISCO, R. H. P. Fim de doze poluentes orgânicos. Revista Eletrônica de Ciências, São Carlos, nº 5, 2002.
NEYENS, E.; BAEYENS, J. A review of classic Fenton’s peroxidation as an advanced oxidation technique. Journal of Hazardous Materials, v. 98, p. 33-50, 2003.
NOGUEIRA, R. F. P.; TROVÓ, A. G.; SILVA, M. R. A.; VILLA, R. D.; OLIVEIRA, M. C. Fundamentos e aplicações ambientais dos processos fenton e foto-fenton. Química Nova, São Paulo, v. 30, nº 2, abr. 2007. Disponível em http://www.scielo.br/scielo.php?script=sci_arttext&pid=S010040422007000200030&lng=pt&nrm=iso. Acesso em: 07 jun. 2011.
NOGUEIRA, R. F. P.; JARDIM, W. F. A fotocatálise heterogênea e sua aplicação ambiental. Química Nova, São Paulo, v. 21, nº 1, p. 69-72, jan./fev. 1998.
PERLATTI, B. Desenvolvimento de métodos para estudo de dioxinas presentes na cinza do bagaço da cana-de-açúcar: avaliação do potencial biomediador de cepas microbianas em compostagem anaeróbica. Disponível em http://www.bdtd.ufscar.br/htdocs/tedeSimplificado/tde_arquivos/18/TDE-2012-05-18T181140Z-4419/Publico/4321.pdf. Acesso em 16 nov. 2015.
QUEIROZ, M. T.; FERNANDES, C. M.; AMORIM, C. C. Uso da energia solar na descontaminação de efluentes industriais. São Paulo, 2011.
RYAN, M. E.; PALEN, W. J.; ADAMS, M.; ROCHEFORT, R. M. Amphibians in the climate vise: loss and restoration of resilience of montane wetland ecosystems in the western US. Frontiers in Ecology and the Environment, v. 12, nº 4, p. 232-240, may 2014. Disponível em http://www.esajournals.org/doi/abs/10.1890/130145?journalCode=fron. Acesso em: 01 dez. 2015
SALEH, M.; KAMEL, A.; RAGAB, A.; EL-BAROTY, G.; EL-SEBAE, A. K. Regional distribution of organochlorine inseticide residues in human milk from Egypt. Journal Environmental Science Health, v. B31, p. 241-255, 1996.
SILVA, C. M. M.; FAY, E. F. Agrotóxicos e ambiente. Brasília: Embrapa Informação Tecnológica, 2007.
SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de Química Analítica. 8ª ed. São Paulo: Thomson Learning, 2007.
TAFFAREL, S. R. Degradação fotocatalítica de estireno em solução aquosa. 2007. Disponível em https://www.google.com.br/?gfe_rd=cr&ei=D4ZlVuu_LIWk8weIl5u4Cw&gws_rd=ssl. Acesso em: 02 nov. 2015
TROVO, A.G.; DALLA VILLA, R.; FERNANDES PUPO NOGUEIRA, R. Utilização de reações foto-fenton na prevenção de contaminações agrícolas. Química Nova, São Paulo, v. 28, nº 5, 2005. Disponível em: http://dx.doi.org/10.1590/S0100-40422012000700018. Acesso em: 02 dez. 2015.
USEPA - U. S. ENVIRONMENTAL PROTECTION AGENCY. Background information on the Children’s Health Chemical Testing Program. Office of Pollution, Prevention and Toxics. 1999. Disponível em: http://www.epa.gov/opptintr/chemrtk/ bkgdoc.html. Acesso em: 22 nov. 2015.
VIEIRA, F. F.; LIMA, C. A. P.; LIMA, G. G. C.; SILVA, Z. E.; SANTOS, C. A. C. Fotocatálise solar: aplicação e tendências atuais. In: Congresso Brasileiro de Engenharia Mecânica, 15, 1999, São Paulo. Disponível em: http://www.abcm.org.br/app/webroot/anais/cobem/1999/pdf/AACHJD.pdf. Acesso em: 04 dez. 2015.
WAKABAYASHI, F. T.; BRITO, M. A. G.; FERREIRA, C. S. Setting the preheating and steady-state operation of electronic ballasts, considering electrodes of hot-cathode fluorescent lamps. IEEE Transactions on Power Electronics, New York, v. 22, nº 3, p. 899-911, 2007.
Sites
WELLE, D. 2015. http://www.cartacapital.com.br/internacional/agente-laranja-o-legado-fatidico-dos-eua-no-vietna-1631.html. Acesso em 15 nov. 2015.
INCCIENCIA. http://incciencia.com.br/2014/11/26/como-reduzir-a-contaminacao-por-dioxinas/. Acesso em: 10 out. 2015.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. http://www.who.int/mediacentre/factsheets/fs225/en/. Acesso em: 18 nov. 2015.
ECYCLE. http://www.ecycle.com.br/component/content/article/35/1073-conheca-os perigos-da-dioxina-e-como-preveni-los.html. Acesso em: 18 nov. 2015.
NAKANO, V.; CAMPOS, M. J. A. http://www.ecolnews.com.br/toxicos_POPs_e_metais_pesados.htm. Acesso em: 15 out. 2015.
PORTAL SÃO FRANCISCO. http://www.portalsaofrancisco.com.br/alfa/dioxina. Acesso em: 20 nov. 2015.
AOCP. http://acpo.org.br. Acesso em: 21 nov. 2015.
INPE. http://satelite.cptec.inpe.br/uv/R-UV.html. Acesso em: 25 nov. 2015.
ACERVO SABER. http://www.acervosaber.com.br/trabalhos/geografia_geral/meteorologia_basica.php. Acesso em: 28 nov. 2015.
UNEP. http://www.unep.org/publications/contents/pub_details_search.asp?ID=274. 2002. Acesso em: 30 nov. 2015.
NACIF, V. 2014. http://incineradornao.net/2014/08/contaminacao-de-ovos-de-galinha-com-dioxinas-furanos-e-pcbs-em-barroso-minas-gerais/. Acesso em: 20 nov. 2015.
[1] Partes por solução: partes em gramas de dioxina - soluto, presentes em um milhão de gramas do herbicida - solução.
[2] Picograma/quilo/dia.
[3] Agência de proteção ambiental americana.
[4] EQT-I = fatores de equivalência internacional; pg = 10g; mc = massa corporal.
[5] TEQ = Toxicidade equivalente. A dioxina 2,3,7,8 - TCDD, considerada a mais tóxica, admite valor 1.
[6] Micrômetro: 1 × 10-6 m.
[7] Micrograma = 10g.
Publicado em 14 de novembro de 2017
Novidades por e-mail
Para receber nossas atualizações semanais, basta você se inscrever em nosso mailing
Este artigo ainda não recebeu nenhum comentário
Deixe seu comentárioEste artigo e os seus comentários não refletem necessariamente a opinião da revista Educação Pública ou da Fundação Cecierj.

