Promovendo ensino com investigação: aulas práticas de Ciências usando avaliações microscópicas do sêmen
Prof. Dr. Daniel Fábio Salvador
Professor associado (Cecierj) e pesquisador (LAEFiB, Instituto Oswaldo Cruz)
Introdução
A avaliação do sêmen animal ou humano é sempre um tema instigante para aulas práticas no laboratório. Essas avaliações, além de não exigirem equipamentos caros e sofisticados, permitem que os alunos visualizem uma das células mais interessantes dos seres vivos: "as células germinativas masculinas" ou, como normalmente chamamos, os "espermatozoides". O ensino de Ciências com investigação promove uma aprendizagem com estímulo ao pensamento crítico, raciocínio, colaboração e resolução de problemas. A investigação também apoia o processo de alfabetização científica, permitindo que os estudantes possam ler, escrever e se comunicar sobre ciência em contextos do mundo real, tornando o aprendizado em Ciências mais significativo e duradouro (Krajcik e Sutherland, 2010).
Durante a atividade práticas em aulas de Ciências, vários assuntos podem ser contextualizados, contribuindo para o interesse e a aprendizagem, especialmente quando essas práticas são investigativas e problematizadoras (Andrade e Massabni, 2011). No tema de aula prática proposto, os professores poderão trabalhar desde aspectos da fisiologia da reprodução masculina e feminina, genética e transmissão de caracteres, uso de microscopia óptica, tamanho das células, biotecnologias, respiração e metabolismo celular até aspectos ligados a comportamento e educação sexual de crianças e jovens.
Neste texto, vamos expor alguns experimentos simples que podem ser feitos em pequenos laboratórios das escolas de Ensino Médio e Fundamental.
Material necessário para a prática
- Microscópio binocular com aumento de 100 a 1.000 vezes.
- Corantes: vermelho congo, eosina, nigrosina, giemsa.
- Câmera de Neubauer para contagem de células (opcional).
- Contador manual de células (opcional).
- 5 eppendorfs ou frascos de 2mL com tampa.
- 5 pipetas de Pasteur de plástico.
- 1 caixa de lâmina para microscopia.
- 1 caixa de lamínula para microscopia.
- Placa aquecedora ou isqueiro manual.
- Papel e lápis para anotar e analisar os resultados.
- Fita para medição de pH.
- Banho-maria (opcional).
- Potes de 5mL para coleta de sêmen (igual ao de coleta de urina).
Proposta para as aulas práticas sobre avaliação microscópica do sêmen
a) Coleta do sêmen
O primeiro passo para a realização desta prática é conseguir o material para análise. Isso pode ser feito de várias formas, em função da espécie escolhida (pesquise em livros da área e na internet). Os sites indicados a seguir trazem informações úteis sobre como realizar coleta de sêmen em animais domésticos:
https://www.portaleducacao.com.br/veterinaria/artigos/33705/coleta-de-semen-em-caes
http://www.uece.br/lfcr/dmdocuments/11_colheita%20semen.pdf.
Nossa sugestão é que você procure um veterinário que possa realizar a coleta de material com antecedência à aula. Como exemplo, você pode procurar uma clínica veterinária na sua cidade e pedir que eles coletem sêmen de cão, gato, galo etc.
Outra possibilidade muito interessante é descongelar amostras de sêmen bovino, caso sejam cedidas por algum fazendeiro que utiliza a prática de inseminação artificial. Nesse caso, pode-se ilustrar vários temas relativos às biotecnologias da reprodução. O inconveniente disso é que o botijão onde as amostras ficam armazenadas em nitrogênio líquido precisa ser transportado até o laboratório da escola. Caso não seja possível o transporte do botijão de nitrogênio, você pode encher uma garrafa térmica comum de café com o nitrogênio líquido e colocar as doses de sêmen dentro dela para transporte até a escola (dura cerca de 2 a 3 horas).
Importante
A garrafa térmica não pode ser totalmente fechada, pois, com a expansão do nitrogênio, pode explodir. Lembre-se também de que o nitrogênio líquido está a -196°C, ou seja, pode causar queimaduras sérias por frio, se houver contato com a pele humana por mais de alguns segundos.
O nitrogênio líquido também desperta a curiosidade e criatividade dos alunos. O professor pode aproveitar a oportunidade para abordar temas referentes aos fenômenos físicos envolvidos.
No caso da análise do sêmen congelado em nitrogênio líquido, as doses precisam ser descongeladas em banho-maria na temperatura de 38ºC por 60 segundos para serem avaliadas em seguida.
O ideal é que o sêmen seja coletado ou descongelado no momento da prática, para que as amostras tenham sêmen vivo durante a aula.
b) Avaliação do sêmen
O processo de avaliação da amostra de sêmen deve começar com a observação dos aspectos físicos mais simples, como volume, aspecto, odor, coloração e medida de pH.
Um passo importante é pedir que os alunos observem e anotem cada um dos itens em todas as amostras de sêmen coletadas (o ideal é que haja de 3 a 5 amostras diferentes de sêmen, se possível de diferentes espécies ou indivíduos).
c) Avaliação estimada da motilidade espermática
A motilidade é realizada colocando uma gota do sêmen entre lâmina e lamínula previamente aquecidas e vistas em microscopia óptica no aumento de 200 ou 400 vezes, em que se fará uma avaliação subjetiva do percentual de espermatozoides com movimentação retilínea progressiva (o resultado deve variar de 0 a 100%). Essa avaliação depende bastante da experiência do técnico observador, mas apresenta alta correlação com a fertilidade, além de ser muito prática e ágil.
A motilidade dos espermatozoides pode ser classificada da seguinte forma:
- Tipo A - espermatozoides móveis com progressão rápida;
- Tipo B - espermatozoides móveis com progressão lenta;
- Tipo C - espermatozoides móveis, porém sem progressão;
- Tipo D - espermatozoides imóveis.
Finalmente, a amostra de sêmen será considerada normal ou anormal segundo o critério:
Normal: > 50% dos tipos A e B
Anormal: < 50% dos tipos A e B
d) Vigor
Vigor é a medida da intensidade e da força de movimentação do espermatozoide, pontuadas de 0 a 5; a intensidade máxima é a passagem rápida e vigorosa do espermatozóide pelo campo de visualização do microscópio.
e) Observação da morfologia espermática
A morfologia é realizada por meio da coloração em microscópio de contraste de fase ou em lâminas coradas no aumento de 1.000 vezes. No caso da coloração, a avaliação é executada após a análise de dois esfregaços de sêmen fresco. Um mínimo de 200 espermatozoides é estudado no aumento de 1.000 vezes. Quanto aos aspectos morfológicos, os espermatozoides são classificados em dois grupos:
- Normal: a cabeça será levemente ovalada, única, lisa, sem gotas citoplasmáticas e com o acrossoma ocupando cerca de 40% a 70% da cabeça. O diâmetro varia de 3 a 5µm, podendo apresentar até dois vacúolos citoplasmáticos. A peça intermediária deve medir de 6 a 10µm, alinhar-se com o eixo longitudinal da cabeça e não apresentar expansões laterais. A cauda deve ser única e desenrolada.
- Anormal: no caso de espermatozoides anormais, as classificações variam de acordo com as espécies.
Para a espécie humana, a classificação mais comum é:
1. Defeitos no acrossoma:
- acrossoma pequeno;
- acrossoma grande.
2. Defeitos do corpo e peça intermediária:
- peça intermediária larga;
- gota intracitoplasmática;
- peça intermediária separada.
3. Defeitos estruturais:
- piriforme;
- achatado;
- em forma de ampulheta;
- superfície irregular;
- mais que dois vacúolos;
- achatado no sítio de implantação da cauda;
- não ovalado de um lado;
- redondo.
4. Defeitos da cauda:
- inserção;
- espiralada;
- ângulo > 90 graus.
f) Como corar os espermatozoides?
Diferentes corantes podem ser utilizados para visualização dos espermatozoides. Veja a seguir os procedimentos de preparo e uso de alguns dos corantes mais utilizados e de fácil preparo.
Coloração de Giemsa (ótima para visualização do acrossoma)
- Fazer o esfregaço delgado com o sêmen fresco e secar ao ar (Figura 1).
- Colocar álcool metílico não diluído sobre a lâmina.
- Deixar descansar por 10 minutos.
- Drenar e secar ao ar.
- Cobrir a lâmina com corante de Giemsa (17 gotas da solução-estoque de Giemsa em água destilada suficiente para se tornar um volume final de 5mL).
- Deixar descansar por 20 minutos.
- Lavar com água destilada.
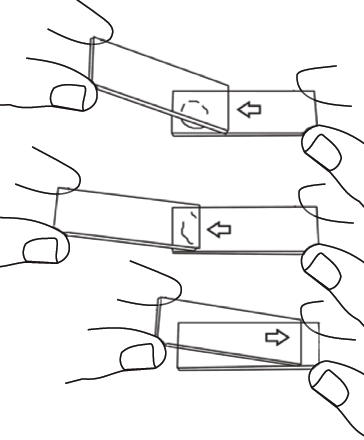
Figura 1: Preparo de um esfregaço de sêmen.
Coloração pelo vermelho congo
- Preparar 100mL de solução aquosa saturada de vermelho congo.
- Preparar 100mL de solução aquosa a 0,5% de violeta genciana.
- Fazer o esfregaço delgado com o sêmen fresco e secar ao ar (Figura 1).
- Imergir a lâmina na solução de vermelho congo por um minuto.
- Lavar em água corrente suavemente e secar ao ar.
- Imergir na solução de violeta genciana por 30 minutos.
- Lavar em água corrente, suavemente e secar ao ar.
g) Vitalidade (avaliação de vivos e mortos)
A vitalidade será avaliada pela combinação dos corantes eosina e nigrosina em esfregaço de sêmen fresco. Essa técnica baseia-se no fato de que as células mortas apresentam membranas lesadas que permitem a penetração de corantes.
Uma contagem de 100 espermatozoides deverá ser realizada em microscópio comum com aumento de 1.000 vezes, de forma a diferenciar as células vivas (não coradas) das mortas (coradas).
As substâncias usadas para a determinação da vitalidade são as seguintes:
- Eosina amarela (Laboratório Merck) na concentração de 3% em solução fisiológica. Estocar na temperatura ambiente.
- Nigrosina hidrossolúvel (Laboratório Merck) na concentração de 8% em solução fisiológica. Filtrar e estocar na temperatura ambiente.
Para corar os espermatozoides, depositar uma gota de sêmen e do corante na ponta de uma lâmina limpa e homogeneizar. Com outra lâmina na posição perpendicular, escorregar em um ângulo de 45º, como mostra a Figura 1, e esperar secar.
As lâminas podem ser observadas em aumento de 200 a 1.000 vezes; o aumento de 1.000 vezes com óleo de imersão é o mais indicado para visualização e contagem individual dos espermatozoides.
O resultado é apresentado na porcentagem total dos espermatozoides vivos (que não se coram). Lembre-se de que os espermatozoides mortos se coram de vermelho.
Uma boa prática é preparar um número maior de lâminas de ejaculados diferentes, marcando números para cada ejaculado na lâmina. Para cada ejaculado pode ser feita mais de uma lâmina, a fim de facilitar a prática em turmas maiores. Em seguida pede-se para cada aluno realizar a contagem de cada lâmina e anotar os dados em um formulário.
Ao final, os alunos podem fazer a média dos resultados encontrados em relação ao percentual de espermatozoides vivos e mortos, avaliando qual coleta está em melhor condição de vitalidade. Sempre que possível, deve-se pedir para os alunos tabularem esses dados em gráficos e tabelas, para que eles aprendam a construir e usar este tipo de recurso, que é um dos maiores problemas para alunos do Ensino Médio e Fundamental.
Os alunos vão observar que, ainda que estejam analisando a mesma amostra com lâminas diferentes para cada grupo, vai haver pequenas variações entre os resultados. Essa é uma ótima oportunidade para comentar variabilidade de resultados na área das Ciências Biológicas.
Fique atento!
É importante lembrar que as avaliações de motilidade e viabilidade possuem grande correlação; logo, um ejaculado com 80% de motilidade não terá 20% de vivos. Caso isso ocorra, algo pode estar errado como o corante, com o método de contagem etc.
Outras células que podem ser observadas no material
Além de espermatozoides normais e patológicos, várias outras células e substâncias podem ser observadas juntamente com o sêmen. A morfologia espermática normal, segundo a CBRA (1998), é definida pela presença de formas normais em 30% ou mais dos espermatozoides examinados. Além disso, deve-se analisar as chamadas formas imaturas, que são definidas como células esféricas que apresentam diâmetro nuclear entre 4 e 9µm e ausência de cauda.
Sugestão de experimento comparativo
Diante do domínio das avaliações citadas, podem ser criados vários experimentos para aulas práticas de laboratório com sêmen animal para estudantes de Ensino Médio e Fundamental. Uma sugestão seria dividir a turma em pequenos grupos que vão processar as amostras de sêmen de cinco diferentes maneiras:
- 0,5mL de sêmen: manter em um frasco com a tampa aberta.
- 0,5mL de sêmen: fechar a tampa do frasco.
- 0,5mL de sêmen: deixar a tampa aberta e adicionar 0,5mL de água.
- 0,5mL de sêmen: deixar a tampa aberta e aquecer em banho-maria a 40ºC.
- 0,5mL de sêmen: deixar a tampa aberta e resfriar a 5ºC (colocar dentro da geladeira).
Depois de os alunos realizarem essas cinco preparações, peça para que façam, com frequência de 5 ou 10 minutos, as avaliações de motilidade, vigor e vitalidade dos espermatozoides de cada frasco. Após tomar os dados num período de 60 minutos, tabular os resultados e explicar as diferenças entre as amostras processadas, buscando justificativas para tais diferenças.
Considerações finais
Como deve ser em toda aula prática, o ideal é que, ao final desses momentos no laboratório, os alunos sejam levados a participar de dinâmicas de grupo em que possam discutir, com a mediação do professor, os resultados encontrados. O professor deve levantar questionamentos não abordados pelos alunos e pedir que anotem e pesquisem o assunto na internet e em bibliotecas (pode-se sugerir visita a bibliotecas universitárias). O professor deve pedir aos alunos também a preparação de um relatório (individual ou por grupo) dos experimentos realizados, contendo resultados e conclusões de cada experimento, pedindo que identifiquem o objetivo de cada análise realizada. Pode-se pedir também que cada relatório possua pelo menos um gráfico ou tabela, para levá-los a trabalhar com metodologia científica.
Este texto tem o objetivo de levantar algumas ideias sobre aplicação prática do conteúdo de reprodução para alunos do Ensino Médio e Fundamental, com a possibilidade de incluir esse tema em suas práticas didáticas. Entretanto, existem outras possibilidades e experimentos que podem ser usados, caso o professor seja criativo e determinado por trabalhar esses conceitos de forma aplicada e contextualizada.
Outra observação importante é que o professor deve realizar todos os experimentos e práticas de laboratório em separado da turma ou com um grupo de monitores para testar todos os procedimentos e equipamentos antes da realização da aula com os alunos. Nesse momento, o professor pode dimensionar melhor o tempo gasto com a aula e escolher as atividades que considera mais relevantes para a turma naquele momento, além de poder criar as variáveis dos experimentos.
Referências
Andrade, M. L. F. de; Massabni, V. G. O desenvolvimento de atividades práticas na escola: um desafio para os professores de ciências. Ciência & Educação, v. 17(4), p. 835–854, 2011. Disponível em http://doi.org/10.1590/S1516-73132011000400005.
CBRA–Colégio Brasileiro de Reprodução Animal. Manual para exame andrológico e avaliação de sêmen animal. Belo Horizonte, CBRA, 1998, 2013.
Krajcik, J. S.; Sutherland, L. M. Supporting students in developing literacy in science. Science (New York, N.Y.), v. 328(5977), p. 456-459, 2010. http://doi.org/10.1126/science.1182593
Publicado em 07 de março de 2017
Novidades por e-mail
Para receber nossas atualizações semanais, basta você se inscrever em nosso mailing
Este artigo ainda não recebeu nenhum comentário
Deixe seu comentárioEste artigo e os seus comentários não refletem necessariamente a opinião da revista Educação Pública ou da Fundação Cecierj.

