Relato de experiência: preparo de slime para ensino de propriedades dos materiais e forças intermoleculares em Química
Erica de Melo Azevedo
Docente universitária (IFRJ - câmpus Duque de Caxias), bacharel e licenciada em Química, doutora em Tecnologia de Processos Químicos e Bioquímicos (UFRJ)
A abordagem contextualizada dos conteúdos escolares é um dos princípios norteadores do currículo do Ensino Médio, de acordo com as Diretrizes Curriculares Nacionais para o Ensino Médio, de 2018. De acordo com os referenciais do documento, é necessária a articulação dos saberes com o contexto histórico, econômico, social, científico, ambiental e cultural, entre outros. A contextualização é um recurso que a escola tem de promover o aluno de uma condição passiva, que apenas recebe o conhecimento, para uma condição ativa, onde é possível facilitar sua participação e atuação na construção do conhecimento e na ligação entre conhecimento teórico e prático.
As metodologias ativas surgem como formas de direcionar o aluno a uma formação crítica, permitindo também a sua autonomia. Para Borges e Alencar (2014), elas são recursos didáticos que ajudam no processo de ensino-aprendizagem, pois possuem potencial para motivar e gerar curiosidade nos educandos. Diversos procedimentos ditos comuns fazem parte de metodologias ativas de ensino-aprendizagem. De acordo com Paiva et al. (2016), entre eles estão os seminários, os trabalhos em grupo, mesas-redondas, debates temáticos, oficinas, leitura comentada, apresentação de filmes, interpretações de musicais, entre outros meios.
Buscando desenvolver um ensino mais contextualizado, mas sem a banalização do conhecimento, o objetivo do presente trabalho foi testar o uso de diferentes substâncias como agentes reticulantes para a formação de slime caseiro buscando desenvolver uma prática sobre ensino de ligações intermoleculares e identificação dos conceitos de viscosidade e elasticidade em turmas de Ensino Médio.
Slime é um material polimérico comercial que apresenta propriedades viscoelásticas e pode ser preparado a partir da reação de um material polimérico com um agente reticulante. O slime comercial é preparado a partir de goma guar, que é uma mistura de polissacarídeos extraídos de plantas leguminosas e apresentam a capacidade de formar ligações de hidrogênio com a água. Esse material é comumente utilizado como espessante e estabilizante em alimentos (Mudgil; Barak; Khatar, 2014; Cassasa, 1986).
Entre as diversas receitas de preparo de slime disponíveis na literatura e na internet em geral, tem-se o uso do polímero álcool polivinílico (PVA) e do agente reticulante tetraborato de sódio, popularmente conhecido como bórax. O PVA é um polímero sintético obtido a partir da hidrólise do poli(acetato de vinila) porque o monômero do PVA não é estável (Young, 2005). Ele é usado nas mais diversas aplicações, como espumas, esponjas, revestimentos, tintas, colas e lentes de contato (Morris et al., 2019).
A água boricada é uma solução comercial utilizada para assepsia e é constituída por uma solução 3% m/m de tetraborato de sódio em meio aquoso. Dessa forma, a água boricada é um material muito utilizado para o preparo de slime caseiro.
A formação do slime ocorre por meio de uma ligação entre as cadeias lineares do polímero PVA, chamado de crosslinking, pela adição do bórax. Forma-se um novo polímero tridimensional que apresenta propriedades viscoelásticas, que é chamado de slime (Bruce et al., 2016).
As propriedades do polímero tridimensional formado variam de acordo com o agente reticulante utilizado. Em geral, quando as ligações entre o agente reticulante e o polímero linear são dos tipos iônicas ou covalente, a interação é forte e forma-se um gel rígido. Do contrário, quando se utiliza um material que forma interações intermoleculares mais fracas entre as cadeias poliméricas lineares, forma-se um material com propriedades mais fluidas. No caso do bórax, os átomos de oxigênio da estrutura formam ligações de hidrogênio com os hidrogênios da hidroxila do polímero PVA.
Materiais
Foram preparadas as soluções de bórax 4%, sulfato de sódio 4%, cloreto de sódio 20%, álcool polivinílico 8%, sulfato de alumínio 20% e cloreto de cálcio 20%. Todas as soluções foram preparadas com concentrações massa/massa. Foram utilizados reagentes em grau puro disponíveis no laboratório da Instituição, com exceção do sulfato de alumínio, que foi adquirido em uma loja para produtos de limpeza de piscinas. Foram utilizados para as misturas béqueres e bastões de vidro.
Para os testes de hidrólise foram utilizadas soluções de HCl e NaOH 0,1 Mol/L disponíveis no estoque do laboratório.
É importante destacar o uso seguro dos reagentes, uma vez que o bórax e o sulfato apresentam toxicidade oral e dermatológica. Nenhum dos dois reagentes foi utilizado diretamente pelos discentes na forma sólida. As soluções foram preparadas seguindo as boas práticas de laboratório e segurança química.
Metodologia
As soluções foram previamente preparadas pela estagiária e pelo docente e as práticas foram realizadas no Laboratório de Química Geral e Inorgânica do Instituto Federal do Rio de Janeiro - Câmpus Duque de Caxias. As práticas foram realizadas por dois grupos de alunos em três semestres consecutivos: 2018.2, 2019.1 e 2019.2 na disciplina Química Inorgânica.
A prática foi separada em três momentos: no primeiro momento, foi feita uma apresentação dialogada com quadro branco acerca dos conceitos de polímero, já que esses conceitos não haviam sido apresentados aos discentes ainda, crosslinking e forças intermoleculares. Logo após esse momento, os discentes preparam um slime a partir de materiais comerciais, usando cola branca e água boricada (Zea Bermudez; Almeida; Seita, 1998).
No segundo momento, cada um dos grupos (A e B) ficou responsável por realizar os experimentos com as soluções 1, 2 e 3, identificadas na Tabela 1. Foram entregues aos alunos um roteiro que deveria ser lido previamente para a realização dos procedimentos. O procedimento está descrito a seguir:
Procedimento experimental
Coloque 10 mL de solução de PVA 4% m/v em um béquer. Acrescente pequena quantidade de corante, se disponível. Meça 10 mL de solução salina e misture à solução de PVA. Agite vigorosamente até a mudança se completar.
Após o procedimento foram entregues as seguintes perguntas aos grupos:
- Quais foram os efeitos das soluções salinas na solução de PVA?
- Por que os diferentes sais resultaram em diferentes propriedades do produto?
Tabela 1 : Soluções utilizadas para o teste de preparo de slime
Grupo A |
Grupo B |
Característica |
|
1 |
Bórax 4% |
Al2(SO4)3 20% |
|
2 |
Na2SO4 20% |
Formaldeído |
|
3 |
NaCl 20% |
CaCl2 20% |
Fonte: Adaptado de Isokawa et al. (2015).
Seguido do preparo desses materiais, foram realizados os testes para avaliar suas propriedades viscoelásticas e a capacidade de espécies ácidas e básicas na hidrólise das cadeias poliméricas, conforme o seguinte procedimento.
Separe uma pequena porção do fluido viscoelástico e faça alguns testes: uma bolinha quica quando jogada sobre a bancada? Em repouso, o que ocorre? Se adicionarmos algumas gotas de HCl, o que ocorre? E se adicionarmos sobre essa mistura gotas de solução de NaOH?
No terceiro momento, em data previamente agendada, os grupos apresentaram um seminário utilizando como recurso vídeos, projetor de multimídia e quadro-negro e foram avaliados pelo professor orientador. O tempo estipulado para a apresentação foi de 20 minutos e foram avaliados critérios como conteúdo e forma dos slides, domínio do conteúdo e tempo de apresentação.
Resultados e discussão
O PVA é um polímero cuja estrutura está representada na Figura 1. Sua cadeia apresenta grupos hidroxila que são capazes de fazer ligações de hidrogênio com a água.
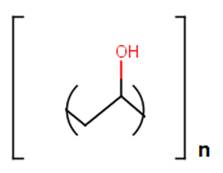
Figura 1 : Estrutura do PVA
O tetraborato de sódio (NaB4O7) é preparado a partir da reação do ácido bórico com metaborato de sódio, conforme a reação a seguir:
2 B(OH)3 + 2 NaBO2 → Na2B4O7 + 3 H2O
Como um sal proveniente de um ácido fraco com uma base forte, o íon tetraborato sofre hidrólise em meio aquoso, formando ácido bórico e metaborato de sódio (reação inversa). O ácido bórico, por sua vez, também sofre hidrólise, de acordo com a seguinte reação:
B(OH)3 + 2 H2O → B(OH)4-+ H3O+
O ácido bórico, como base de Bronsted, é capaz de receber íons H+ da água, formando a base conjugada B(OH)4-, que pode interagir com o PVA. Forma-se um tampão alcalino ácido bórico-metaborato (Sereda; Hawkins, 2018). Em baixas concentrações, o borato forma ligações coordenadas com os oxigênios das hidroxilas do PVA em meio aquoso (Figura 2).
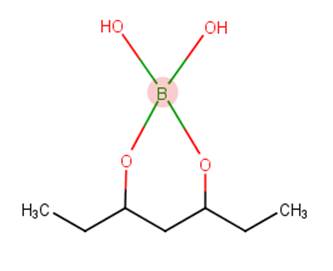
Figura 2 : Interação do borato com a cadeia do PVA
O borato é capaz de formar ligações coordenadas com as cadeias poliméricas do PVA, unindo as cadeias para formar ligações intermoleculares ou intramoleculares e resultando numa estrutura polimérica tridimensional, que permite o deslizamento de uma cadeia sobre a outra, sem romper essas ligações. Quando o crosslinking entre as cadeias acontece em grande extensão forma-se um material com características de um semissólido gelatinoso. A ligação entre as cadeias poliméricas é fraca e pode ser facilmente desfeita dissolução do polímero formado em água. Isso é possível devido às interações intermoleculares do tipo ligação de hidrogênio entre o PVA e a água. De maneira semelhante, o grau de reticulação pode ser controlado pela mudança na concentração do bórax no meio, que é feito geralmente por titulação com um ácido forte. Ao adicionar um ácido forte, ocorre uma neutralização de parte do tetraborato, reduzindo a sua concentração e reticulação. Esse tipo de experimento é utilizado para explicar a relação entre as propriedades microscópicas e macroscópicas dos materiais (Nyasulu; Macklin, 2006; McLaughlin, 1997; Teh et al., 2016).
Na Figura 3 é apresentada uma imagem do material produzido a partir da reação do bórax com PVA. O slime obtido apresentava aspecto translúcido, era viscoelástico, e ao realizar o teste sobre a superfície da bancada, observou-se que o mesmo ricocheteava ao ser lançado. Ao ser puxado lentamente, esticava-se, devido à elasticidade; ao ser segurado pelas pontas dos dedos, escoava lentamente.

Figura 3: Slime produzido a partir de bórax e PVA
A síntese do slime utilizando bórax ou água boricada permite a abordagem de uma série de discussões envolvendo teorias ácido-base, ligações coordenadas e interações intermoleculares de forma contextualizada.
Como citado, o uso de diferentes soluções na síntese influencia nas propriedades físico-químicas do gel formado. Foram utilizadas soluções de Na2SO4, NaCl, CaCl2, Al2(SO4)3 e formaldeído. Em relação aos sais, percebe-se que a diferença entre os três está na carga dos íons presentes em solução, uma vez que os sais sofrem dissociação em meio aquoso. O sulfato de alumínio é o sal que apresenta íons com cargas mais altas. Em presença de água, o íon Al3+ forma aquacomplexo, conforme a reação a seguir:
Al3+ + 6 H2O → [Al(H2O)6]3+
O Al3+ atua como ácido de Lewis, e a água, que é o ligante, atua como base de Lewis. O complexo formado é capaz de neutralizar as cargas negativas presentes em tamanho coloidal. Por isso o Al2(SO4)3 é comumente utilizado com agente coagulante e floculante na limpeza de reservatórios de água, piscinas e em tratamento de água. A neutralização de cargas que antes eram iguais promove a junção das partículas de tamanho coloidal, processo chamado de coagulação. Sob agitação, as partículas que agora apresentam cargas opostas se juntam, formando partículas maiores no processo de floculação.
No caso da síntese do polímero utilizando o sulfato de alumínio, forma-se um material gelificado que apresenta características próximas ao slime preparado bórax, mas não é considerado um slime. A característica viscosa está associada à resistência ao escoamento e pode ser comprovada segurando-se o material produzido e esperando alguns segundos para observar seu escoamento lento. A característica elástica, que está associada à remoção da deformação ao cessar a aplicação da força pode ser observada a partir da formação de uma ‘bolinha’ com o material e jogando-se esse objeto sobre uma superfície plana. Devido à sua característica elástica, este irá saltar. Ao colocar o material sobre a superfície plana e aplicar uma força com o dedo, observa-se uma leve deformação, com espalhamento. Ao cessar a aplicação desta força, o material retorna para a condição bem próxima da inicial. A propriedade viscoelástica pode ser observada a partir do esticamento lento e esticamento rápido do material. Ao esticar lentamente, o material tende a se deformar sem se romper, até certo limite; e ao esticar rapidamente, o material se rompe (Zea Bermudez; Almeida; Seita, 1998).
Na Figura 4, é apresentada a mistura da solução de PVA com NaCl. A solução de NaCl não forma o material gelificado devido à baixa carga dos íons provenientes desse sal. Por este motivo, não ocorre o processo de coagulação e floculação. O Na2SO4 forma um gel rígido, cuja característica pode ser observada esticando-se o material lentamente ou abruptamente. De ambos os modos, o material se rompe, sem fluir. Isso pode ser explicado devido à carga dos íons provenientes da dissociação desse sal. Por fim, o uso do formaldeído não propiciou a formação de um material rígido, conforme conta na literatura. A explicação para este resultado é devido à baixa concentração do reagente disponível. Como a compra deste reagente é controlada por órgãos específicos, não foi possível adquirir um novo frasco do reagente.

Figura 4: Material produzido a partir da mistura de PVA com solução de NaCl
Na Figura 5, é apresentada a imagem do slime produzido a partir da reação do PVA com a solução de Na2SO4. O material obtido apresentou aspecto opaco e rigidez ao ser deformado (esticado lentamente e rapidamente) em comparação ao slime produzido a partir da reação com bórax.

Figura 5: Slime produzido a partir da reação de PVA com Na2SO4
A coagulação ocorre em meio ácido e a adição de uma base forte, como o NaOH, desfaz o processo de coagulação. Desta forma, a adição da solução de NaOH faz com que o hidrogel se rompa, formando pequenos pedaços. Como a reação é reversível, a adição de HCl forma novamente o hidrogel inicial. Além das propriedades avaliadas a partir do uso de diferentes sais e da mudança de pH do meio, é possível realizar um estudo mais aprofundando da influência do pH nas propriedades do gel, utilizando-se soluções tampão, por exemplo, ou bases e ácidos mais fracos.
As apresentações dos grupos nos três semestres consecutivos mostram que o processo de ensino-aprendizagem de conceitos importantes de Química pode ser realizado de forma contextualizada e divertida. É possível relacionar conceitos diversos a partir de uma única prática e utilizando materiais de baixo custo. Os experimentos podem ser desenvolvidos com turmas do ensino médio de Química Geral, Química Orgânica e Química Inorgânica.
Conclusão
Entre as soluções utilizadas, observou-se que apenas o bórax formou o slime, que é um material com propriedades viscoelásticas. O sulfato de alumínio promoveu a formação de um material gelatinoso de aspecto mais rígido em comparação ao slime. As soluções de NaCl, CaCl2 e Na2SO4 não promoveram o processo de gelificação, devido às cargas das espécies iônicas em meio aquoso.
A partir de uma prática simples para obtenção de um material popular utilizando como um item de diversão, como o slime, é possível aplicar conhecimentos de Química, como teorias ácido-base, polimerização, viscosidade, elasticidade, coagulação e floculação, de forma contextualizada. O presente relato de experiência é uma proposta de aplicação de metodologia ativa no ensino de Química no ensino básico. Esse tipo de prática pode ser aplicada em diferentes espaços de ensino e utilizando outros materiais, de forma a promover uma discussão mais detalhada, até mesmo em cursos de graduação, para a formação de docentes e/ou cursos de atualização de profissionais da área de Educação.
Referências
BORGES, T. S.; ALENCAR, G. Metodologias ativas na formação crítica do estudante: o uso das metodologias ativas como recurso didático na formação crítica do estudante de Ensino Superior. Cairu em Revista, nº 4, p. 119-143, 2014.
BRUCE, M. R. M.; BRUCE, A. E.; AVARGIL, S.; AMAR, F. G.; WEMYSS, T. M.; FLOOD, V. J. Polymers and crosslinking: a core experiment to help students think on the submicroscopic level. Journal of Chemical Education, v. 93, nº 9, p. 1.599-1.605, 2016.
CASASSA, E. Z.; SARQUIS, A. M.; VAN DYCKE, C. H. The gelation of polyvinyl alcohol with borax: a novel class participation experiment involving the preparation and properties of a slime. Journal of Chemical Education, v. 63, nº 1, p.57-60, 1986.
ISOKAWA, N.; FUEDA, K.; MIYAGAWA, K.; KANNO, K. Demonstration of the coagulation and diffusion of homemade slime prepared under acidic conditions without borate. Journal of Chemical Education, v. 92, nº 11, p. 1.886-1.888, 2015.
LÓPEZ-MALDONADO, E. A.; OROPEZA-GUZMAN, M. T.; JURADO- BAIZAVAL, J. L.; OCHOA-TERÁN, A. Coagulation−flocculation mechanisms in wastewater treatment plants through zeta potential measurements. Journal of Hazardous Materials, v. 279, nº 30, p. 1-10, 2014.
MATILAINEN, A.; VEPSÄLÄINEN, M.; SILLANPÄÄ, M. Natural organic matter removal by coagulation during drinking water treatment: a review. Advanced Colloid Interface Science, v. 159, nº 2, p. 189-197, 2010.
McLAUGHLIN, K. W.; WYFFELS, N. K.; JENTZ, A. B.; KEENAN, M. V. The gelation of poly(vinyl alcohol) with Na2B4O7.10H2O: killing slime. Journal of Chemical Education, v. 74, nº 1, p. 97-99, 1997.
MORRIS, R. K.; HILKER, A. P.; MATTICE, T. M.; DONOVAN, S. M.; WENTZEL, M. T.; WILLOUGHBY, P. H. Simple and versatile protocol for preparing self-healing poly(vinyl alcohol) hydrogels. Journal of Chemical Education, v. 96, nº 10, p. 2.247-2.252, 2019.
MUDGIL, D.; BARAK, S; KHATAR, B. S. Guar gum: processing, properties and food applications – a review. Journal of Food Science and Technology, v. 51, nº 3, p. 409-418, 2014.
NYASULU, F. W.; MACKLIN, J. Intermolecular and intramolecular forces: a general chemistry laboratory comparison of hydrogen bonding in maleic and fumaric acids. Journal of Chemical Education, v. 83, nº 5, p. 1-3, 2006.
PAIVA, M. R.; PARENTE, J. R.; BRANDÃO, I. R.; QUEIROZ, A. H. Metodologias ativas de ensino-aprendizagem: revisão integrativa. Revista de Políticas Públicas, v. 15, nº 2, p. 145-153, 2016.
SEREDA, G.; HAWKINS, B. Introducing students to the medical applications of cross-linked hydrogels using nontoxic materials and experiments suitable for many settings. Journal of Chemical Education, v. 95, p. 1-3, 2018.
SHEN, J.; TONELLI, A. E. Demonstrating unique behaviors of polymers. Journal of Chemical Education, v. 94, nº 11, p. 1.738-1.745, 2017.
SHERMAN, M. Polymers, polymers, everywhere!: a workshop for pre-high school teachers and students. Journal of Chemical Education, v. 64, nº 10, p. 868-869, 1987.
SHIBAYAMA, M.; SATO, M.; KIMURA, Y.; FUJIWARA, H.; NOMURA, S. 11B n.m.r. study on the reaction of poly(vinyl alcohol) with boric acid. Polymer, v. 29, nº 2, p. 336-340, 1988.
TEH, C. Y.; BUDIMAN, P. M.; SHAK, K. P. Y.; WU, T. Y. Recent advancement of coagulation–flocculation and its application in wastewater treatment. Industrial & Engineering Chemistry Research, v. 55, nº 16, p. 4.363-4.389, 2016.
YOUNG, J. A. Poly(vinyl alcohol). Journal of Chemical Education, v. 82, nº 10, p. 1.466, 2005.
ZEA BERMUDEZ, V.; ALMEIDA, P. P. de; SEITA, J. F. How to learn and have fun with poly (vinyl alcohol) and white glue. Journal of Chemical Education, v. 75, nº 11, p. 1.410-1.418, 1998.
Agradecimentos
A autora agradece ao Instituto Federal do Rio de Janeiro pelo suporte e infraestrutura para a realização dos experimentos.
Publicado em 02 de fevereiro de 2021
Como citar este artigo (ABNT)
AZEVEDO, Erica de Melo. Relato de experiência: preparo de slime para ensino de propriedades dos materiais e forças intermoleculares em Química. Revista Educação Pública, v. 21, nº 4, 2 de fevereiro de 2021. Disponível em: https://educacaopublica.cecierj.edu.br/artigos/21/4/relato-de-experiencia-preparo-de-islimei-para-ensino-de-propriedades-dos-materiais-e-forcas-intermoleculares-em-quimica
Novidades por e-mail
Para receber nossas atualizações semanais, basta você se inscrever em nosso mailing
Este artigo ainda não recebeu nenhum comentário
Deixe seu comentárioEste artigo e os seus comentários não refletem necessariamente a opinião da revista Educação Pública ou da Fundação Cecierj.

