(Re)Visitando o clássico experimento da condutividade de soluções eletrolíticas
Danielle da Silva
Licenciada em Química (UTFPR – câmpus Campo Mourão)
Rafaelle Bonzanini Romero
Doutora em Ciências (Unicamp), professora da UTFPR – câmpus Campo Mourão
Adriano Lopes Romero
Doutor em Educação em Ciências e Educação Matemática (Unioeste), professor da UTFPR – câmpus Campo Mourão
O teste de condutividade elétrica de soluções aquosas é frequentemente abordado em livros didáticos de Química do Ensino Médio, sendo empregado geralmente para o ensino de conteúdos relacionados a sais, substâncias com caráter ácido ou básico e ligações químicas. Embora possua base conceitual rica, a atividade experimental associada a esse teste, em nossa perspectiva, não tem sido plenamente explorada, resultando em uma conexão limitada entre a Ciência e o cotidiano do aluno. No intuito de abordar essa lacuna, apresentamos neste trabalho uma proposta de atividade experimental que busca explorar o conceito de condutividade elétrica de soluções aquosas, utilizando-o como ferramenta para determinar a qualidade de bebidas isotônicas.
Cumpre destacar que as bebidas isotônicas são formuladas com o propósito de restabelecer eletrólitos e líquidos perdidos pelo organismo pelo suor durante atividades físicas. É importante salientar que diversas marcas comerciais de isotônicos apresentam distintos teores de sais minerais, como sódio, potássio, cálcio e magnésio. Sites populares, como a Wikipédia, definem isotônico como
bebida constituída por água, sais minerais e carboidratos (6 a 8 por cento), contendo formação semelhante ao plasma (para facilitar sua absorção). São ricos em cálcio, potássio, fósforo e sódio e foram desenvolvidas para repor líquidos e sais minerais perdidos pelo suor durante a transpiração.
O Dicionário Priberam da Língua Portuguesa, por outro lado, apresenta uma definição baseada em termos científicos para o verbete isotônico, ao considerá-lo como:
1. Que tem a mesma concentração molecular, e, por consequência, o mesmo poder osmótico. 2. Cuja concentração de moléculas é semelhante aos fluidos do corpo humano (ex.: as bebidas isotônicas repõem a água e os sais minerais perdidos durante a transpiração).
Por sua vez, o Dicionário de Química de Oxford indica que isotônico "descreve soluções que têm a mesma pressão osmótica" (Daintith, 2008, p. 298, tradução nossa). Essa, por sua vez, "depende apenas da concentração de partículas na solução, não de sua natureza (ou seja, é uma propriedade coligativa)" (Daintith, 2008, p. 391, tradução nossa).
Aspectos históricos da condutividade de soluções eletrolíticas
As leis fundamentais da condução eletrolítica foram desenvolvidas durante o século XIX. Entre os vários agentes históricos que contribuíram para esse desenvolvimento podemos citar o físico-químico britânico Michael Faraday (1791-1867), com os artigos Relation by measure of common and voltaic electricity (de 1833) e On electrochemical decomposition (de 1834), o físico alemão Johann Wilhelm Hittorf (1824-1914), com o artigo On the migration of ions during electrolysis (de 1853), e o físico alemão Friedrich Wilhelm Georg Kohlrausch (1840-1910), com o artigo On the conductivity of electrolytes dissolved in water in relation to the migration op their components (de 1876). Esse conjunto de artigos foi reunido no livro The fundamental laws of electrolytic conduction: memories by Faraday, Hittorf and F. Kohleausch (de 1899) pelo físico estadunidense Harry Manley Goodwin (1870-1949).
Segundo Goodwin (1899), com o estabelecimento das leis de Faraday, Hittorf e Kohlrausch, o caminho foi preparado para a teoria da dissociação, desenvolvida pelo físico sueco Svante Arrhenius (1859-1927), anunciada em 1886, assim que nasceu a teoria das soluções, formulada pelo químico neerlandês Jacobus Henricus van't Hoff (1852-1911).
Vale ressaltar que van't Hoff, "em reconhecimento aos serviços extraordinários que prestou pela descoberta das leis da dinâmica química e da pressão osmótica em soluções", foi o primeiro pesquisador a receber o Prêmio Nobel de Química, que se iniciou em 1901. Dois anos depois, em 1903, Arrhenius recebeu o Prêmio Nobel de Química "em reconhecimento aos serviços extraordinários concedidos ao avanço da Química pela sua teoria eletrolítica da dissociação".
Em virtude da relevância do poder explicativo inerente à teoria eletrolítica da dissociação elaborada por Arrhenius, observa-se que a teoria foi prontamente incorporada nos livros didáticos de Química, assim como em obras destinadas ao exame do desenvolvimento histórico dessa teoria. Como exemplos desse último tipo de produção mencionado, destacam-se os livros The theory of electrolytic dissociation and some of its applications (de 1900), elaborado por físico-químico estadunidense Harry Clary Jones (1865-1916), e The electrolytic dissociation theory (de 1907), elaborado pelo químico alemão Richard Wilhelm Heinrich Abegg (1869-1910), aluno e amigo de Arrhenius.
No período em que Jones (1900) redigiu sua obra, já se tinha conhecimento de que todos os compostos capazes de gerar uma pressão osmótica e, por conseguinte, de ser dissociados em íons conduziam corrente quando em solução aquosa, caracterizando-se, assim, como eletrólitos. Essa modalidade de dissociação passou a ser denominada dissociação eletrolítica e a teoria desenvolvida por Arrhenius foi formalizada como a Teoria da Dissociação Eletrolítica. Jones, ao abordar a teoria de Arrhenius, argumenta que "uma coisa é propor uma teoria, e outra é propor uma teoria que seja verdadeira" (Jones, 1900, p. 103, tradução nossa). Esse argumento evidencia que a teoria proposta por Arrhenius estava firmemente estabelecida e era amplamente aceita entre os praticantes da Química, na época.
Abegg (1907) relata que, no ano de 1887, quando Arrhenius propôs a Teoria da Dissociação Eletrolítica (ionização), a Físico-Química estava transitando de uma posição de mero atrativo secundário para assumir posição central e mais relevante no interesse dos químicos. Já há algum tempo, propriedades físicas bastante intrigantes vinham sendo objeto de estudo. Entretanto, mesmo com a descoberta de leis gerais, as quais, em conjunto com o químico e filósofo alemão Friedrich Wilhelm Ostwald (1853-1932), resumimos atualmente sob o título de "propriedades aditivas", nenhuma delas contribuiu de maneira significativa para abordar os problemas de constituição que, na época, eram proeminentes nas mentes dos químicos orgânicos.
Por meio de várias investigações acerca da condutividade de soluções eletrolíticas e considerando a teoria de van't Hoff do estado de substâncias dissolvidas em água, Arrhenius foi induzido a contemplar os denominados eletrólitos, abrangendo ácidos, bases e sais, especialmente no âmbito da Química Inorgânica, como entidades divididas em constituintes definidos e, em geral, predominantemente constituídas por íons. Esses íons, portadores de carga elétrica, conduzem a corrente elétrica ao se movimentarem por meio da solução em direção aos eletrodos (Abegg, 1907).
Como o nome dissociação eletrolítica indica, a teoria de Arrhenius inclui todas as substâncias que chamamos de eletrólitos, ou seja, as substâncias que conduzem à corrente galvânica de tal forma que um movimento de massas materiais ocorre simultaneamente nas direções das correntes positiva e negativa. Segundo Abegg (1907), já se sabia há muito tempo que esse tipo peculiar de condução elétrica é uma propriedade dos sais, ácidos e bases e, por meio deles, quase todas as substâncias pertencentes ao campo da Química Inorgânica. A partir do trabalho de Hittorf, em 1853, foi compreendido que a condução elétrica é a característica essencial das substâncias conhecidas como "sais" no sentido mais amplo; portanto, os ácidos passaram a ser vistos como sais de hidrogênio e as bases como sais de hidroxila. Desse modo, foi formulado pela primeira vez um conceito claro de "sal" sobre o qual a longa experiência havia nos dado uma noção prática, mas ainda assim inexata (Abegg, 1907).
Partindo dessa concepção fundamental, alcançam-se prontamente as definições precisas de ácidos e bases, cuja busca havia sido de longa data e sem sucesso. Embora fosse reconhecido que seus constituintes característicos eram H e OH, respectivamente, ainda não se conseguia determinar em que circunstâncias esses componentes manifestavam propriedades ácidas ou básicas, visto que numerosos compostos contendo H ou OH não são necessariamente ácidos ou bases. A teoria da dissociação, no entanto, esclarece essas substâncias como as que contêm H ou OH na forma de íons, resultado da dissociação eletrolítica, proporcionando imediatamente uma abordagem clara para compreender o grau das propriedades ácidas ou básicas de um composto, ao determinar a concentração desses íons H· [atualmente representamos por H+] ou OH' [atualmente representamos por OH-] (Abegg, 1907).
Na Figura 1, apresentamos fotografias de alguns dos agentes históricos que se dedicaram ao estudo de soluções, cujos conhecimentos produzidos contribuíram direta ou indiretamente para o desenvolvimento da Teoria da Dissociação Eletrolítica de Arrhenius.

Figura 1: Agentes históricos que se dedicaram ao estudo de soluções
Fonte: As imagens dos pesquisadores foram retiradas da Wikipédia.
No âmbito dos livros didáticos, apenas para fins de exemplificação, apresentamos, na Figura 2, três esquemas que explicam a condutividade de soluções eletrolíticas, utilizando evidências experimentais a partir da teoria da dissociação eletrolítica de Arrhenius.
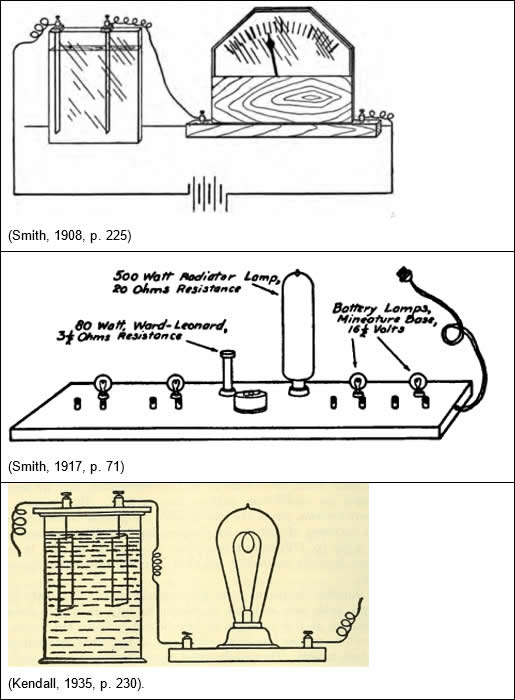
Figura 2: Representações do experimento da condutividade de soluções eletrolíticas presentes em livros didáticos de Química do século XIX
Metodologia
A proposta experimental apresentada possui caráter didático e a análise dos seus resultados exibe uma ótica qualitativa. Para a realização do teste de condutividade elétrica utilizou-se o dispositivo indicado na figura 3 que possui três lâmpadas de diferentes potências, denominadas de L3 = lâmpada de 40W, L2 = lâmpada de 7W e L1 = LED de 3W. Diferentes amostras líquidas podem ser submetidas ao teste de condutividade de corrente elétrica, como os isotônicos comerciais e naturais: isotônico Gatorade®, isotônico Powerade®, hidrotônico I9 Powerade®, água de coco Kero Coco®, água de coco Native®, água de coco in natura, refrigerante H2OH®, refrigerante Aquarius Fresh®, soro fisiológico, água mineral Crystal®, água mineral Safira®.

Figura 3: Dispositivo utilizado para o teste de condutividade elétrica de soluções
Para avaliar a condutividade de corrente elétrica nas amostras é necessário imergir as extremidades desencapadas dos fios do dispositivo, devidamente conectados à fonte de energia que, no caso em análise, fornece uma corrente elétrica com tensão de 127V. Ao inserir os eletrodos no líquido, estabelecendo o circuito, a detecção da passagem da corrente será indicada pelo acendimento das lâmpadas e a intensidade luminosa resultante poderá fornecer uma avaliação relativa de sua condutividade, podendo ser categorizada para fins de comparação, como: M (moderada), F (forte) ou Fr (fraca).
Para instituições educacionais que não dispõem de um testador de condutividade elétrica de soluções como o indicado neste estudo, sugerimos a fabricação de um dispositivo semelhante ao descrito por Santos et al. (2019). Como alternativa para mitigar possíveis riscos de choques elétricos, recomenda-se a utilização de fontes de energia com tensões mais baixas, como as fornecidas por baterias de 9V. Nesse sentido, ao proceder com a montagem do dispositivo para a medição da condutividade elétrica, aconselhamos fixar uma extremidade dos fios de cobre na lâmpada de LED e a outra extremidade à bateria de 9V. Posteriormente, realiza-se o corte de um dos fios, expondo as extremidades do cobre (eletrodos), resultando em um dispositivo semelhante ao indicado por Santos, Cortes Junior e Santos (2021).
Resultados esperados e discussões do experimento no escopo da Química
Ao submeter diversas amostras ao teste de condutividade elétrica (Figura 4), constatou-se que os produtos comercializados como isotônicos exibiram resultados distintos (Quadro 1).

Figura 4: Ilustração do experimento de condutividade elétrica
Quadro 1: Resultados observados nos testes de condutividade elétrica
Amostras avaliadas |
Preço dos produtos |
Resultados observados |
Isotônico Gatorade® |
500 ml, R$ 5,13 |
L3 – M |
Isotônico Powerade® |
500 ml, R$ 6,62 |
L3 – F |
Hidrotônico I9 Powerade® |
500 ml, R$ 5,00 |
L2 – M |
Água de coco Kero Coco® |
1 L, R$ 10,80 |
L3 – F |
Água de coco Native® |
330 ml, R$ 6,90 |
L3 – F |
Água de coco in natura |
1 unidade, R$ 5,00 |
L3 – F |
Refrigerante H2OH® |
500 ml, R$ 4,31 |
L1 – Fr |
Refrigerante Aquarius Flesh® |
510 ml, R$ 3,30 |
L1 – Fr |
Soro fisiológico |
250 ml, R$ 6,00 |
L3 – F |
Água Mineral Crystal® |
500 ml, R$ 2,42 |
Não acende |
Água Mineral Safira® |
500 ml, R$ 2,20 |
Não acende |
L3 = Lâmpada de 40W, L2 = Lâmpada de 7W, L1 = LED de 3W. M = moderado, F = forte, Fr = fraco.
No experimento conduzido, os dois isotônicos apresentaram distintas condutividades elétricas, evidenciadas pela intensidade luminosa na lâmpada de 40W. Notadamente, o produto da marca Powerade® permitiu que a lâmpada fosse acesa com intensidade forte, enquanto o isotônico da marca Gatorade® propiciou um acendimento com intensidade moderada. É relevante destacar que a intensidade luminosa está diretamente relacionada à eficácia do fechamento do circuito pela solução, dependendo, por conseguinte, da quantidade de íons dissolvidos. A análise comparativa sugere que o produto Powerade® possui concentração mais elevada de íons, em comparação com o Gatorade®. Para aprofundar essa reflexão, sugere-se que o professor estimule os estudantes a realizar uma comparação entre as tabelas nutricionais dos produtos. Esse procedimento visa associar o teor de íons informado nas tabelas nutricionais às intensidades de acendimento da lâmpada observadas durante a atividade experimental. Essa abordagem ampliada pode enriquecer a compreensão dos estudantes da relação entre a composição química dos isotônicos e sua condutividade elétrica, estimulando uma análise crítica e integrada dos dados obtidos.
O hidrotônico I9 Powerade®, ao ser submetido ao teste de condutividade elétrica, revelou condutividade inferior àquela apresentada pelos dois isotônicos, evidenciada pelo acendimento moderado da lâmpada de 7W. Esse resultado suscita uma reflexão pertinente sobre a distinção entre "hidrotônico" e "isotônico". De acordo com as informações fornecidas pelos fabricantes desses produtos, embora ambos sejam considerados bebidas energéticas formuladas com sais minerais e carboidratos em composição semelhante à do corpo humano, eles se diferenciam. O isotônico, por ser mais concentrado e conter maior quantidade de eletrólitos, é recomendado para a reposição de nutrientes após exercícios físicos de alta intensidade, uma vez que essa reposição ocorre de maneira mais rápida. Em contrapartida, o hidrotônico apresenta a mesma formulação, porém com menor quantidade de eletrólitos, resultando em uma reposição mais gradual. Portanto, é indicado para o consumo após atividades físicas moderadas.
Para ponderar sobre a distinção entre isotônicos e hidrotônicos, sugere-se que o professor incentive os estudantes a comparar as tabelas nutricionais dos dois produtos, buscando estabelecer uma relação entre as discrepâncias na composição química tanto qualitativa quanto quantitativamente para posterior correlação dessas diferenças aos resultados observados na atividade experimental. A tabela nutricional do hidrotônico I9 Powerade® é apresentada na Tabela 1, enquanto a do isotônico Powerade® é exibida na Tabela 2. Esse método de análise pode enriquecer a compreensão dos estudantes, possibilitando uma conexão mais detalhada entre as características químicas dos produtos e os resultados obtidos na investigação conduzida.
Tabela 1: Tabela nutricional do hidrotônico i9 Powerade®
Porção de 200ml |
||
Quantidade por porção |
% VD (*) |
|
Valor energético |
36kcal = 151kJ |
2 |
Carboidratos |
8,4g |
3 |
Sódio |
57mg |
2 |
Cloreto |
49mg |
** |
Potássio |
46mg |
** |
(*) % Valores diários de referência com base em uma dieta de 2.000kcal ou 8.400kJ. Seus valores diários podem ser maiores ou menores, dependendo de suas necessidades energéticas. (**) VD não estabelecido.
Fonte: Reprodução da tabela nutricional do produto.
Tabela 2: Tabela nutricional do isotônico Powerade®
Porção de 200 ml |
||
Quantidade por porção |
%VD (*) |
|
Valor energético |
45kcal = 188kJ |
2 |
Carboidratos |
11g |
4 |
Proteínas |
0g |
0 |
Gorduras totais |
0g |
0 |
Gorduras saturadas |
0g |
0 |
Gorduras trans |
0g |
0 |
Fibra alimentar |
0g |
0 |
Sódio |
90mg |
4 |
Vitamina B3 |
2,4mg |
15 |
Vitamina B6 |
0,19mg |
15 |
Vitamina B12 |
0,36μg |
15 |
Cloreto |
134mg |
** |
Potássio |
20mg |
** |
(*) % Valores diários de referência com base em uma dieta de 2.000 kcal ou 8.400 kJ. Seus valores diários podem ser maiores ou menores, dependendo de suas necessidades energéticas. (**) % Valores diários não estabelecidos.
Fonte: Reprodução da tabela nutricional do produto.
Destaca-se que as três amostras de água de coco, tanto as processadas quanto in natura, revelaram-se melhores condutoras de corrente elétrica, em comparação com o hidrotônico e isotônicos avaliados.
Para fins de comparação, procedeu-se à determinação da condutividade elétrica de duas águas minerais, de dois refrigerantes de baixa caloria (H2OH e Aquarius Fresh) e de um soro fisiológico (0,9% de cloreto de sódio, adquirido em farmácia local). Os resultados indicaram propriedades não condutoras, fracamente condutoras e condutoras, respectivamente. A análise comparativa dos dados apresentados no Quadro 1 sugere que as amostras de água de coco possuem concentração superior de sais minerais em relação aos isotônicos, corroborando as informações presentes nos rótulos dos produtos avaliados.
Ao término das análises de condutividade elétrica realizadas em diversos produtos comerciais, incluindo hidrotônicos, isotônicos, água de coco, refrigerantes e água mineral, sugere-se que o professor estimule os estudantes a contemplar a relação custo-benefício. Esse exercício propõe a associação entre o preço desses produtos e o teor de sais minerais que apresentam. Dessa maneira, é possível promover uma reflexão crítica quanto às estratégias publicitárias adotadas por alguns produtos, notadamente os hidrotônicos e isotônicos, que buscam incentivar sua aquisição com base na promessa de proporcionar hidratação e reposição de sais minerais, especialmente durante a prática de atividades esportivas. Esse direcionamento analítico permite aos estudantes uma compreensão mais abrangente das escolhas de consumo, considerando não apenas as características químicas dos produtos, mas também fatores econômicos e publicitários que influenciam nas decisões de compra.
Considerações finais
A proposta de atividade experimental apresentada permite explorar o conceito de condutividade elétrica de soluções aquosas podendo ser utilizada, de forma qualitativa, baseada em evidências visuais, como ferramenta para determinar a qualidade de bebidas isotônicas. Verificamos que os resultados experimentais provenientes da execução da atividade podem servir para problematizar a função dos produtos comercializados como isotônicos. Essa análise pode ser estendida para uma comparação abrangente com produtos de origem natural, exemplificado pela água de coco, que se destaca por possuir concentrações mais elevadas de sais minerais, promovendo um perfil nutricional mais favorável à saúde. Além disso, é notável que esses produtos naturais, em geral, apresentam custos inferiores, se comparados aos seus equivalentes artificiais.
A metodologia empregada na atividade relatada, quando desenvolvida de forma investigativa, amplia significativamente as possibilidades de discussões, transcendendo os limites estritamente científicos, abrangendo dimensões sociais e econômicas. Dessa forma, a atividade não apenas enriquece o entendimento dos aspectos químicos envolvidos, como também contribui para a formação de um consumidor mais crítico, capacitado para tomar decisões informadas e conscientes.
Referências
ABBEGG, R. The electrolytic dissociation theory. New York: John Wiley Sons, 1907.
BEBIDA esportiva. In: Wikipédia. Disponível em: https://pt.wikipedia.org/wiki/Bebida_esportiva. Acesso em: 1 nov. 2023.
DAINTITH, J. A Dictionary of Chemistry. New York: Oxford University Press, 2008.
GOODWIN, H. M. The fundamental laws of electrolytic conduction - memories by Fakaday, Hittorf and F. Kohleausch. New York, London: Harper & Brothers, 1899.
ISOTÔNICO. In: Dicionário Priberam da Língua Portuguesa. Disponível em: https://dicionario.priberam.org/isotônico. Acesso em: 1 nov. 2023.
JONES, H. C. The theory of electrolytic dissociation and some of its applications. New York: Macmillan, 1900.
KENDALL, J. Smith's College Chemistry. 3ª ed. New York, London: D. Appleton-Century, 1935.
SANTOS, A. T. et al. Experimentação em sala de aula: resultados de uma atividade simples realizada no nível médio para ensino de condutividade elétrica. Scientia Naturalis, v. 1, n° 3, p. 209-219, 2019.
SANTOS, I. F.; CORTES JUNIOR, L. P.; SANTOS, D. C. Modelos para condução elétrica em solução eletrolítica propostos por estudantes de graduação. Brazilian Journal of Development, v. 7, n° 5, p. 50.271-50.287, 2021.
SMITH, A. General Chemistry for colleges. New York: Century, 1908.
SMITH, A. A laboratory outline of college chemistry. New York: Century, 1917.
Publicado em 10 de dezembro de 2024
Como citar este artigo (ABNT)
SILVA, Danielle da; ROMERO, Rafaelle Bonzanini; ROMERO, Adriano Lopes. (Re)Visitando o clássico experimento da condutividade de soluções eletrolíticas. Revista Educação Pública, Rio de Janeiro, v. 24, nº 45, 10 de dezembro de 2024. Disponível em: https://educacaopublica.cecierj.edu.br/artigos/24/45/revisitando-o-classico-experimento-da-condutividade-de-solucoes-eletroliticas
Novidades por e-mail
Para receber nossas atualizações semanais, basta você se inscrever em nosso mailing
Este artigo ainda não recebeu nenhum comentário
Deixe seu comentárioEste artigo e os seus comentários não refletem necessariamente a opinião da revista Educação Pública ou da Fundação Cecierj.

